瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
“老”关节炎新靶点!南方医科大学团队开发智能纳米凝胶,从根源逆转骨关节炎
443 人阅读发布时间:2025-11-04 15:45
杂志名称:Small
影响因子:13.3
文章题目:Betulinic Acid Self-Assembled Nanodelivery System Attenuates Osteoa阿rthritis by Dually Modulating Macrophage Polarization and Macrophage-Chondrocyte Crosstalk via Disruption of the GSK3β/NF-κB/CCL20 Axis
白桦酸自组装纳米递送系统通过破坏GSK3β/NF-κB/CCL20轴,双调节巨噬细胞极化和巨噬细胞-软骨细胞串扰,减轻骨关节炎
第一作者:刘琴文
通讯作者:官道刚
作者单位:南方医科大、香港浸会大学等
本实验所用产品:检测25种小鼠趋化因子抗体芯片(RayBiotech, GSM-CHE-1)

实验样品类型:RAW264.7巨噬细胞条件培养基
研究摘要
骨关节炎(OA)是一种以滑膜炎和软骨退化为特征的退行性关节疾病,目前缺乏有效的疾病修饰疗法。本研究开发了一种叶酸修饰的聚白桦脂酸纳米颗粒负载温敏水凝胶(FA-PBA NPs@Gel),用于靶向递送白桦脂酸(BA),并通过双重调控巨噬细胞极化和巨噬细胞-软骨细胞相互作用,揭示其在OA治疗中的潜力与机制。
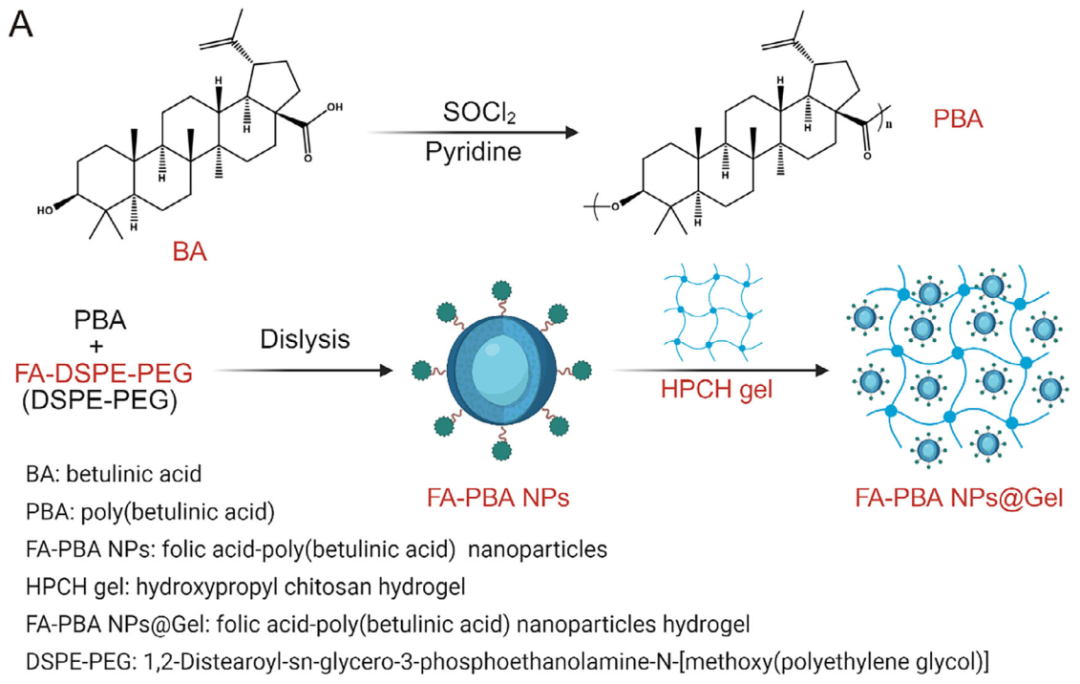
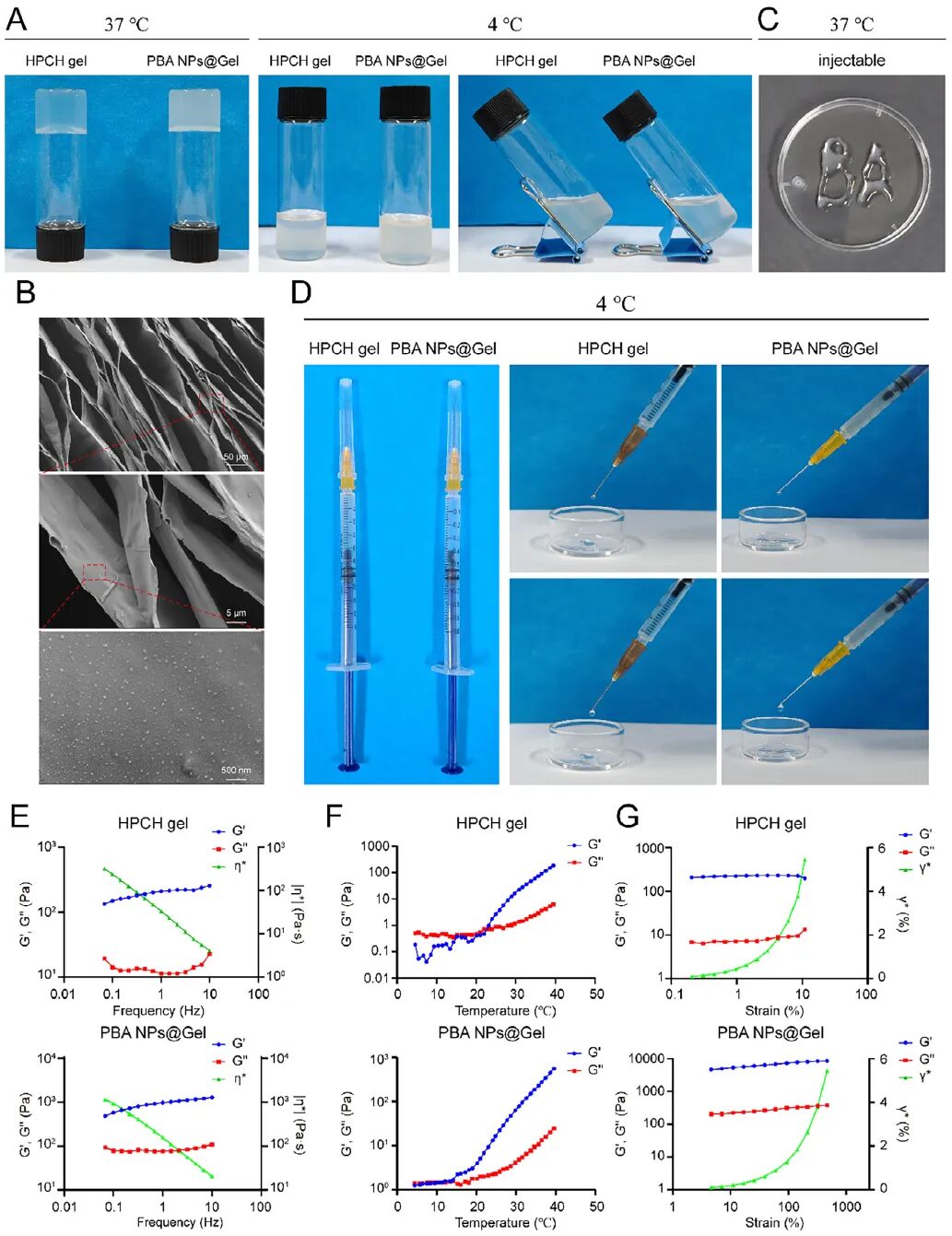
1、FA-PBA NPs@Gel的构建与表征,并测评其细胞毒性与生物相容性
研究人员通过直接缩聚法合成了聚白桦脂酸(PBA),并进一步制备了FA修饰的PBA纳米颗粒(FA-PBA NPs),并将其负载于温敏性羟丙基壳聚糖水凝胶中。该体系具有优异的可注射性、温敏凝胶化特性及持续释放能力。体外释放实验显示,35天内可释放约85%的药物,表明其具有长效缓释潜力。
通过活/死细胞染色、细胞形态观察和溶血实验,证实FA-PBA NPs@Gel对巨噬细胞和软骨细胞无明显毒性,溶血率低于2%,具备良好的生物相容性。
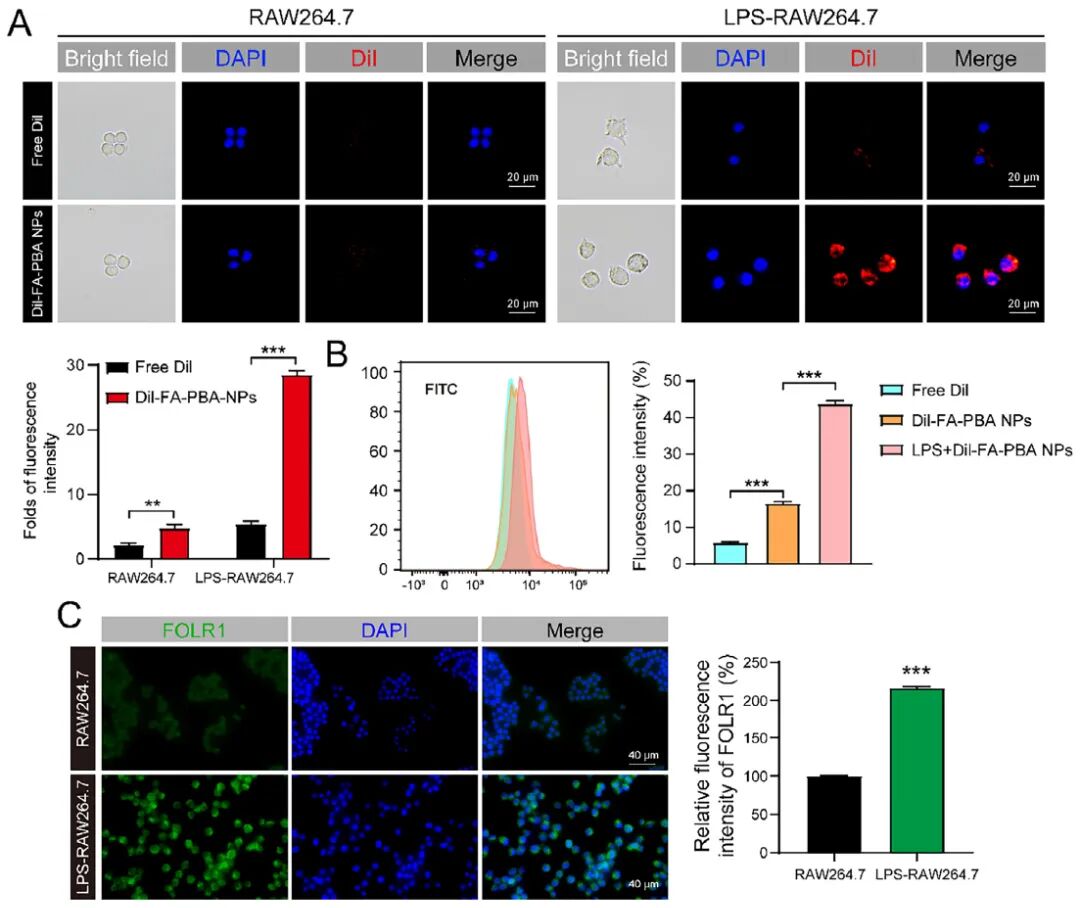
2、 FA-PBA NPs@Gel靶向M1型巨噬细胞,并促进M1向M2型巨噬细胞转化
通过Dil标记的FA-PBA NPs,结合免疫荧光和流式细胞术,发现FA-PBA NPs@Gel可通过叶酸受体FOLR1特异性内吞至LPS激活的M1巨噬细胞,其摄取量显著高于非激活细胞或游离Dil组。
qPCR、免疫荧光和流式结果显示,FA-PBA NPs@Gel显著下调M1标志物(IL-1β, iNOS, CD86),上调M2标志物(Arg1, TGF-β, CD206),并降低细胞内ROS水平,表明其可有效重塑巨噬细胞表型。

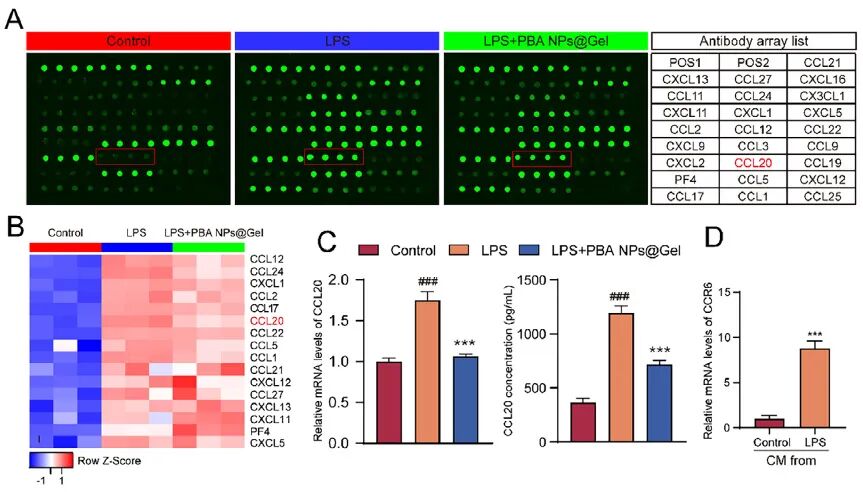
3、 FA-PBA NPs@Gel通过抑制NF-κB通路减少CCL20分泌,抑制CCL20/CCR6轴保护软骨形成
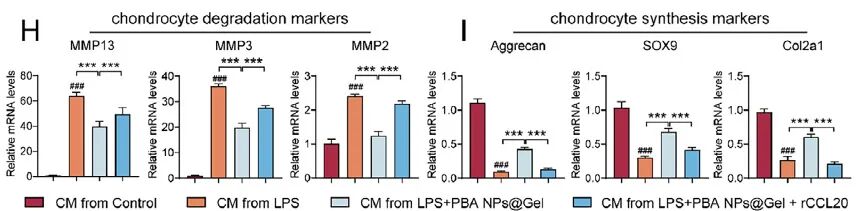
利用抗体芯片(RayBiotech, GSM-CHE-1,检测小鼠样本中25种趋化因子)筛选发现,FA-PBA NPs@Gel显著下调巨噬细胞分泌的CCL20。进一步实验证实,其通过抑制CCL20/CCR6信号通路,改善软骨细胞形态、促进增殖与迁移,并上调软骨合成相关基因(Aggrecan, SOX9, Col2a1),下调降解相关基因(MMP13, MMP3, MMP2)。
进一步机制探索中RNA-seq与KEGG分析显示,FA-PBA NPs@Gel显著抑制NF-κB通路激活。Western blot和免疫荧光证实其抑制p65磷酸化与核转位,并下调NF-κB下游基因表达。
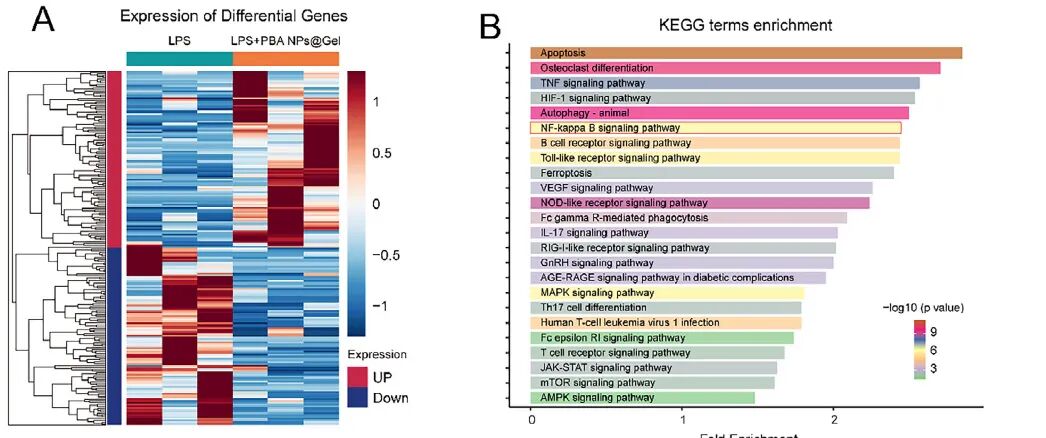
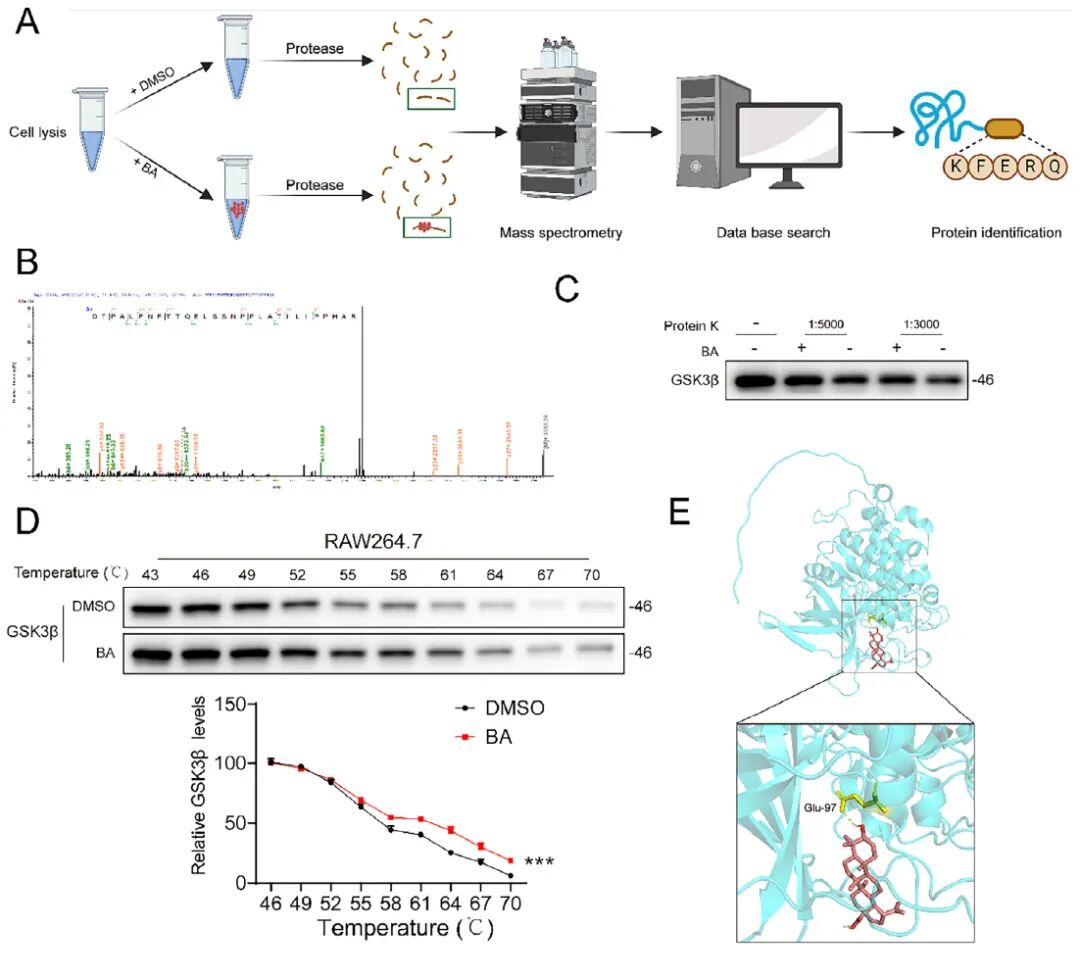
4、分子对接实验表明,BA直接靶向GSK3β蛋白以抑制NF-κB通路
通过DARTS-MS联合分子对接、CETSA和分子动力学模拟,发现BA直接结合GSK3β的Glu-97位点,增强其蛋白稳定性,从而抑制NF-κB通路激活。
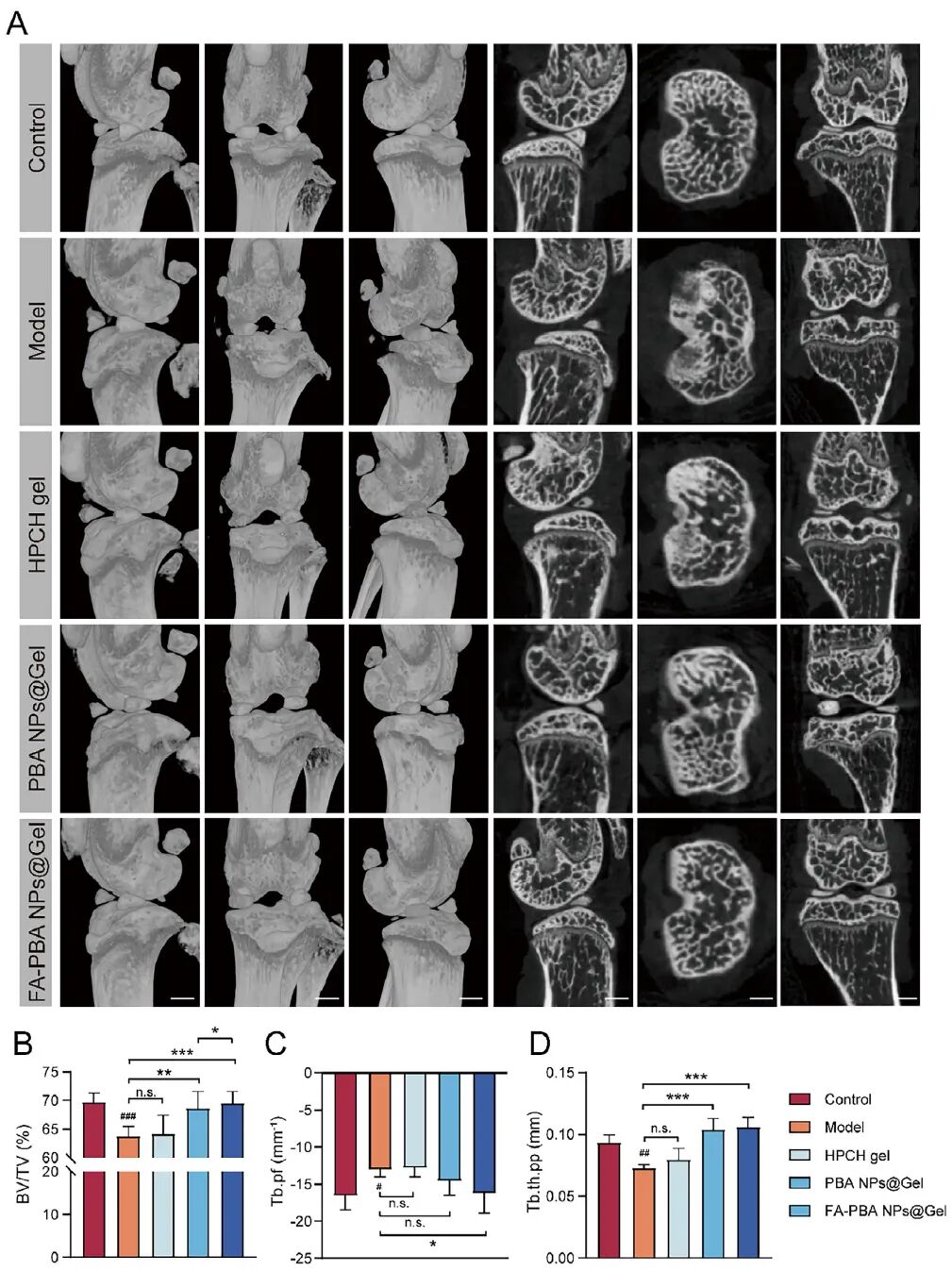
5、FA-PBA NPs@Gel在体内缓解滑膜炎并具备良好生物相容性,并改善软骨破坏与软骨下骨异常
在ACLT诱导的OA模型中,FA-PBA NPs@Gel显著改善滑膜增生、减少M1巨噬细胞浸润、提升M2比例,并降低血清CCL20水平。组织学与血液生化分析证实其具有良好的体内安全性
SOFG染色、H&E染色及Micro-CT分析显示,FA-PBA NPs@Gel有效减轻软骨退化、促进ECM合成,并改善软骨下骨结构参数(BV/TV, Tb.Th, Tb.Pf),表明其在结构层面对OA具有治疗作用。