瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
IF29 突破!“白血病芯片” 问世,CAR-T 疗法临床前筛选有了新神器
273 人阅读发布时间:2025-10-13 17:22
期刊名称:Nature Biomedical Engineering
影响因子:29
文章题目:Bioengineered immunocompetent preclinical trial-on-chip tool enables screening of CAR T cell therapy for leukaemia
第一作者:Chao Ma
通讯作者:Saba Ghassemi、陈伟强
作者单位:纽约大学坦登工程学院机械与航空航天工程系、生物医学工程系等
产品应用:AAH-INF-3(检测人类样本中40种炎症相关低丰度表达因子)
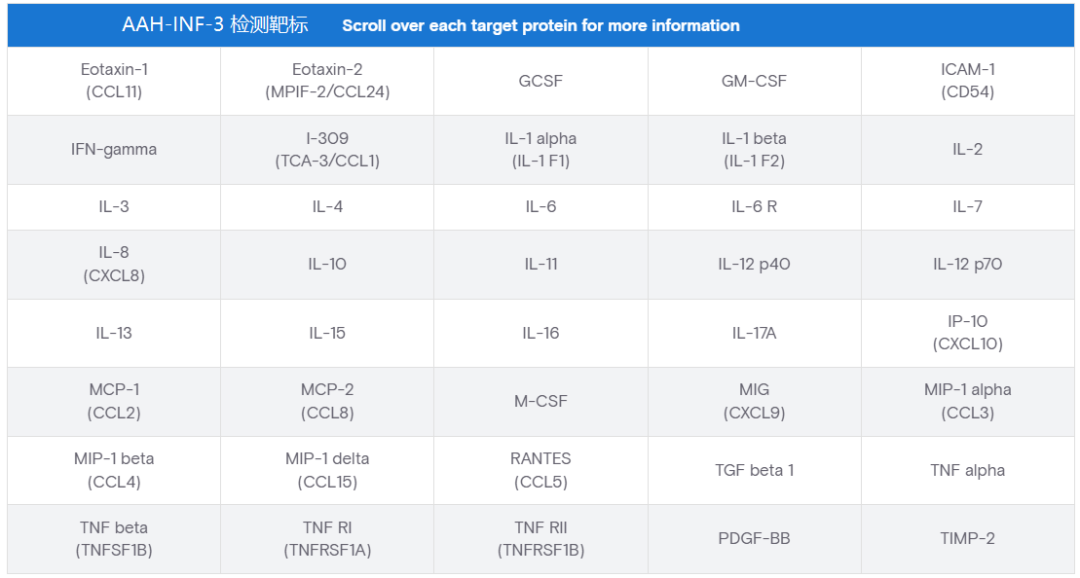
检测样本:细胞上清
研究背景
嵌合抗原受体(CAR)T 细胞免疫疗法是治疗血液系统恶性肿瘤(如 B 细胞急性淋巴细胞白血病、弥漫性大 B 细胞淋巴瘤、多发性骨髓瘤)的重要手段,但临床疗效存在显著异质性 —— 近半数患者在长期随访中出现疾病复发,且伴随细胞因子释放综合征、免疫效应细胞相关神经毒性综合征等严重副作用。
目前 CAR T 细胞治疗失败的机制已部分明确,包括 T 细胞功能障碍、肿瘤细胞表面抗原丢失 / 下调 / 突变、谱系转换及死亡配体功能受损等,但尚无有效分子标志物可预测患者应答。
现有临床前评估平台存在明显局限:
1、体外模型
(如 2D 细胞共培养、3D 肿瘤球 / 类器官)无法模拟肿瘤微环境的完整结构(血管、基质、免疫成分),难以实现 CAR T 细胞迁移、跨血管浸润等时空动态评估;
2、体内动物模型
多为免疫缺陷或免疫背景与人类差异显著,且无法实时原位监测 CAR T 细胞与肿瘤微环境的相互作用。
因此,亟需开发一种具有人类生理相关性的精准免疫肿瘤学工具,以实现 CAR T 细胞疗法的快速、深度评估。
研究结果
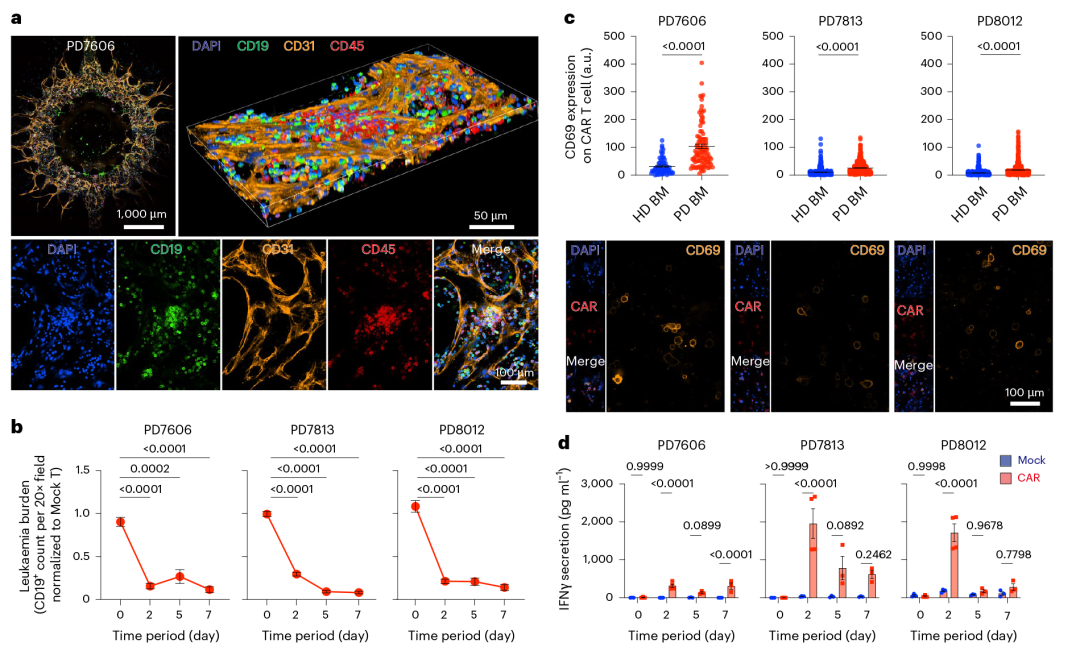
1. 构建体外免疫活性白血病芯片,复现人类白血病骨髓微环境
为填补临床前评估的生物学与技术空白,研究团队设计了一种 3D 血管化、免疫活性的人类白血病骨髓微环境芯片,其结构与功能高度模拟体内骨髓:
结构设计:芯片包含三个互联区域 —— 中央窦(血管化区域)、髓腔(骨髓细胞与白血病细胞区域)、骨内膜区(成骨细胞与成纤维细胞区域),采用聚二甲基硅氧烷(PDMS)复刻成型;
细胞组成:加载人原代骨髓单个核细胞(造血细胞)、基质细胞(血管内皮细胞、间充质干细胞、成骨细胞、成纤维细胞)及白血病细胞,通过血管内皮细胞自组装形成可灌注血管网络;
生物学验证:单细胞 RNA 测序(scRNA-seq)显示,芯片培养 9 天后仍维持与体内骨髓相似的造血细胞和基质细胞组成;免疫染色证实芯片中存在 CD8+ T 细胞、CD4+ T 细胞、CD14 + 单核细胞、CD68 + 巨噬细胞等免疫细胞,且基质细胞可自主沉积层粘连蛋白、纤连蛋白、IV 型胶原等细胞外基质(ECM),进一步增强微环境仿生度。
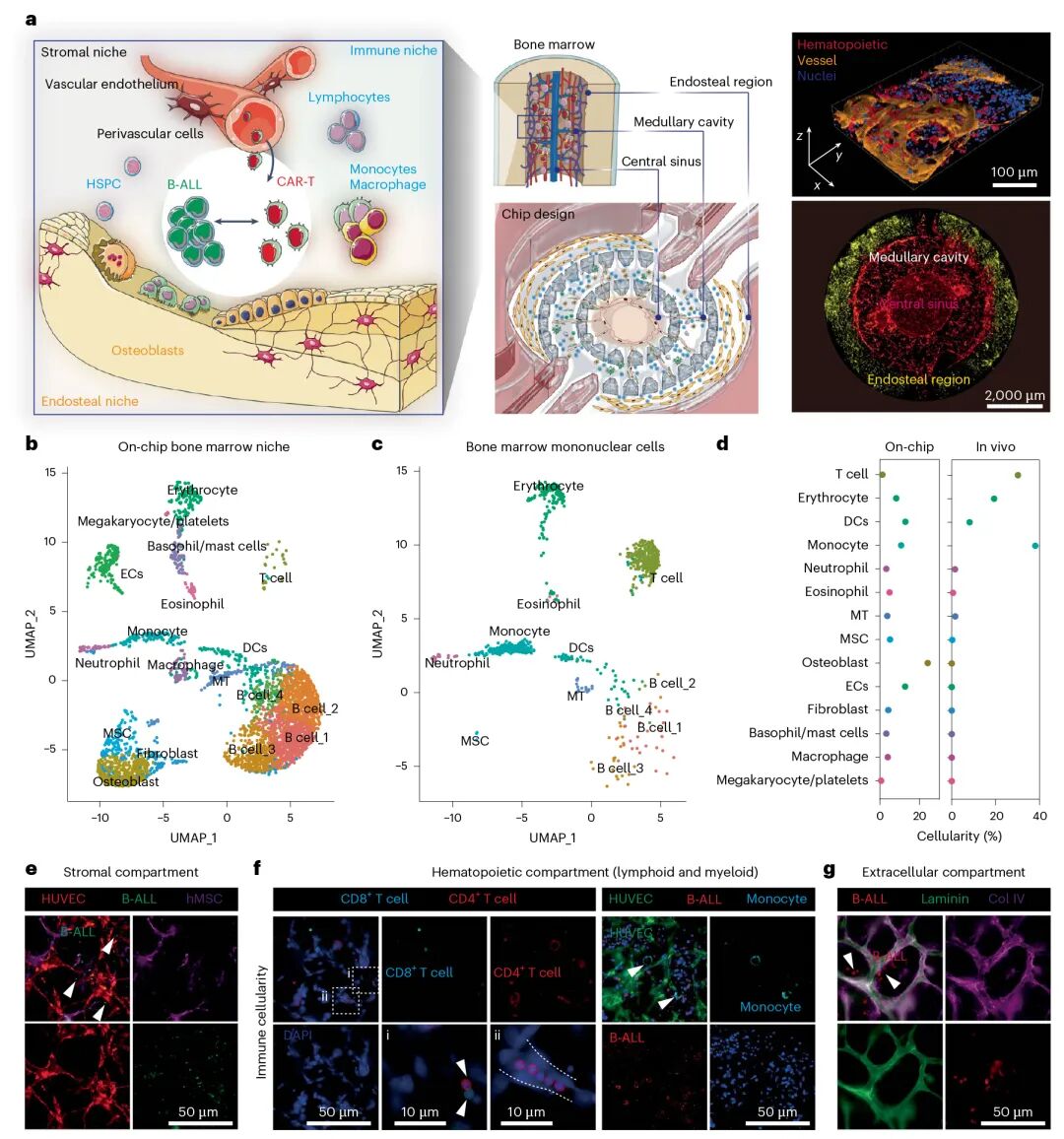
2. 实时监测 CAR T 细胞在芯片中的动态功能
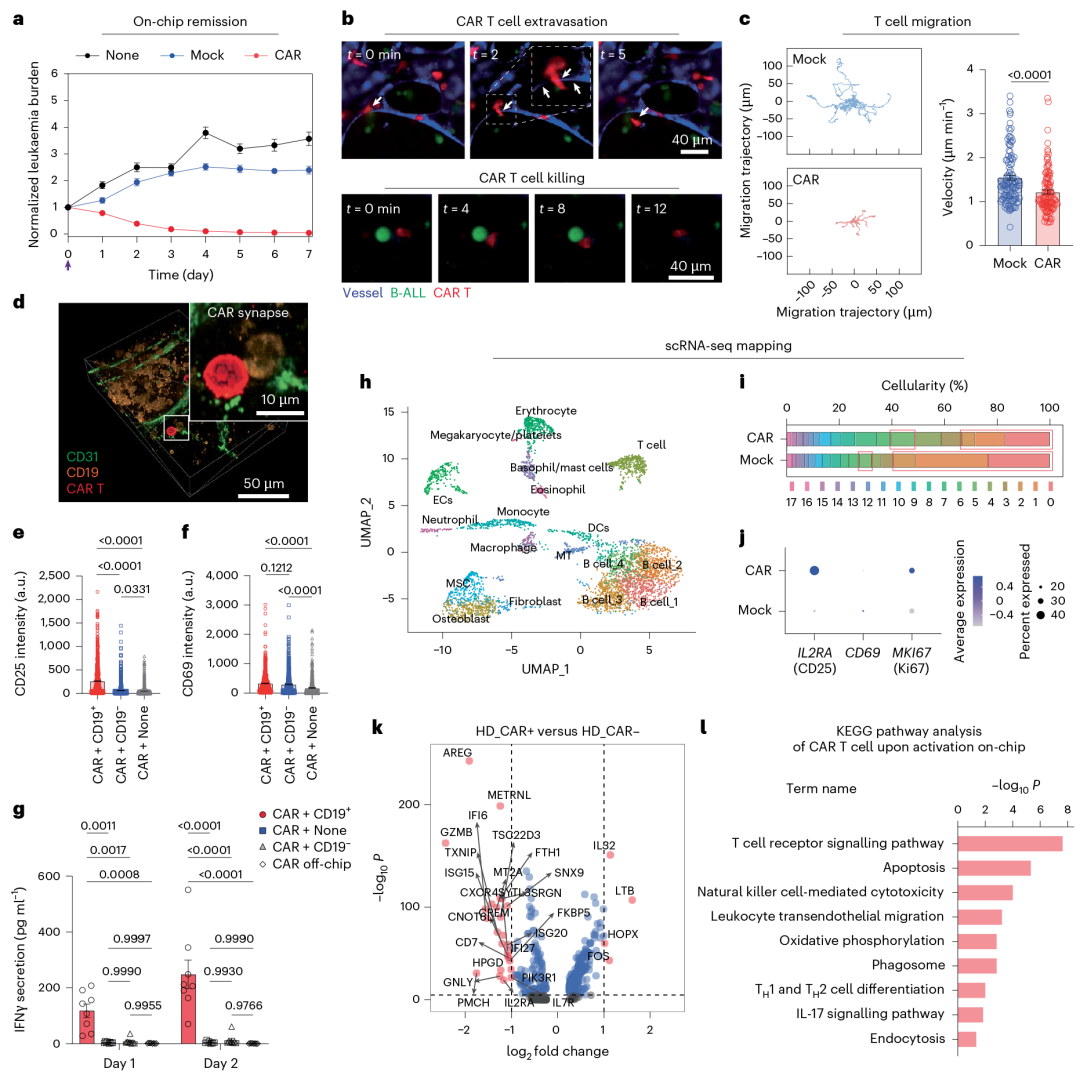
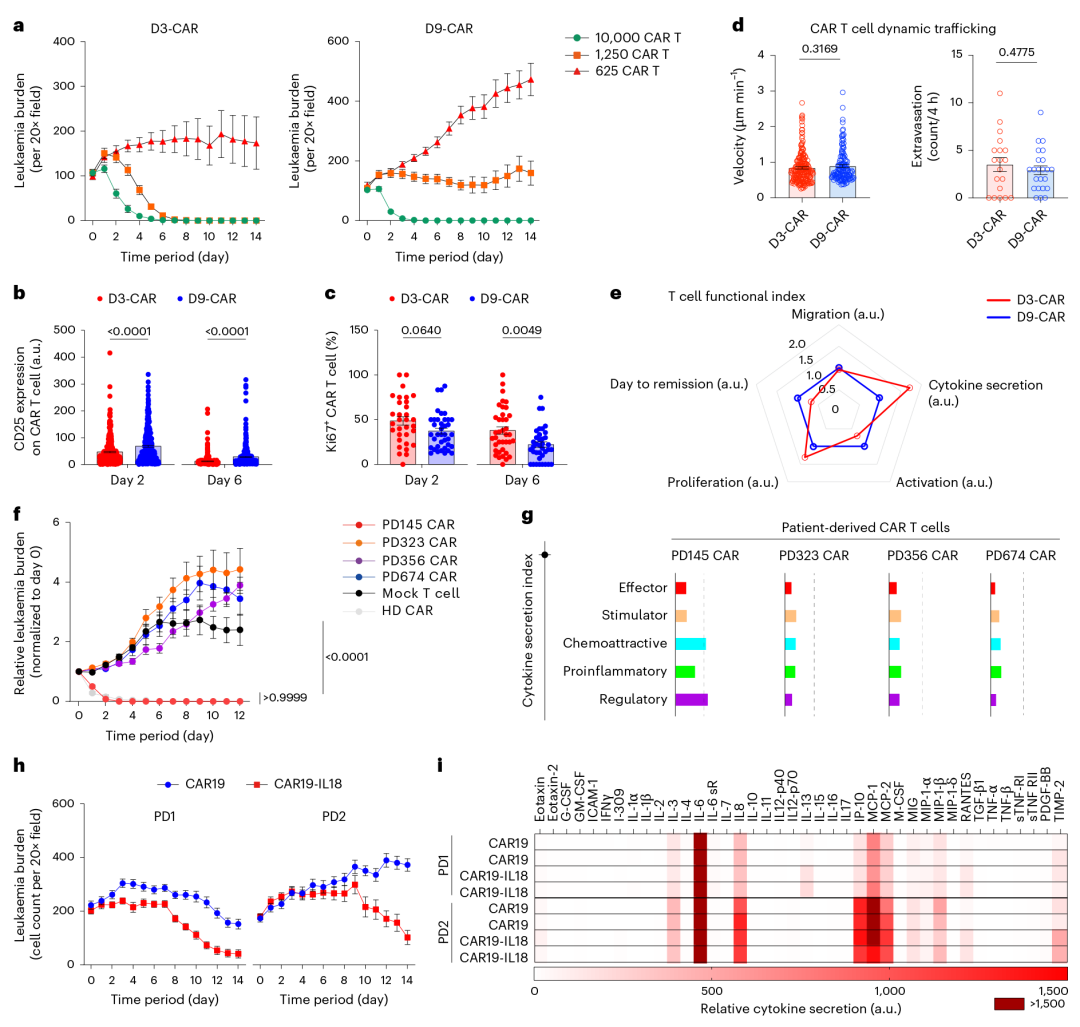
该研究以抗 CD19 第二代 4-1BBζ-CAR T 细胞为模型,在芯片中实现其时空动态监测,结果显示:3 天内以 1:1 比例杀伤约 70% 白血病细胞、7 天清除率超 99%(Mock T 细胞及未处理组无效);血管化芯片助其早期快速分布,非血管化芯片增强其晚期扩增,且能捕获其跨血管外渗与浸润过程;CAR T 细胞与靶细胞作用后,激活标志物、细胞毒性细胞因子及增殖标志物表达均升高,scRNA-seq 也证实相关功能通路激活。
3. 解析 CAR T 细胞与白血病微环境的相互作用
通过多维度检测揭示 CAR T 细胞与骨髓微环境的双向调控关系:
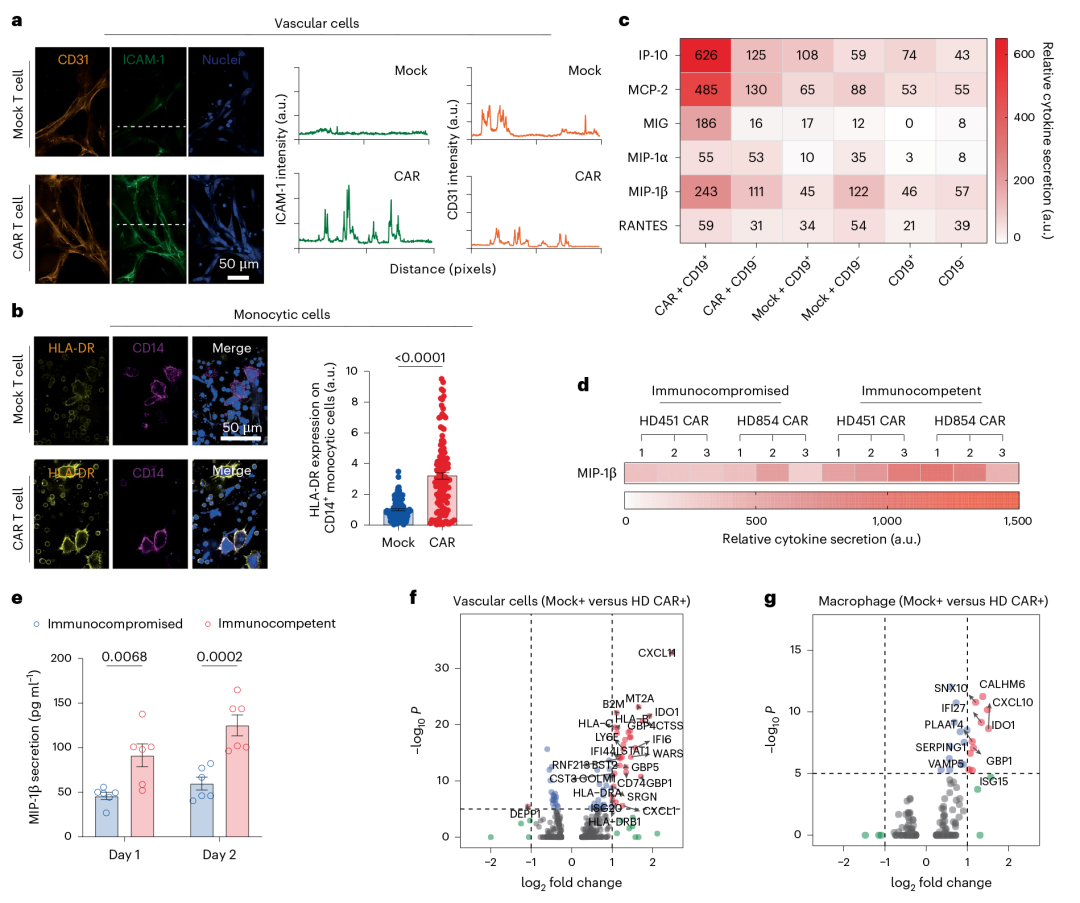
微环境调控 CAR T 细胞:CAR T 细胞处理后,利用多因子检测芯片(AAH-INF-3)分析40种小鼠细胞因子,发现血管内皮细胞 ICAM-1、CD14 + 单核细胞 HLA-DR 表达升高,芯片中 MIP-1β、RANTES、MCP-2 等细胞因子 / 趋化因子分泌显著增加;
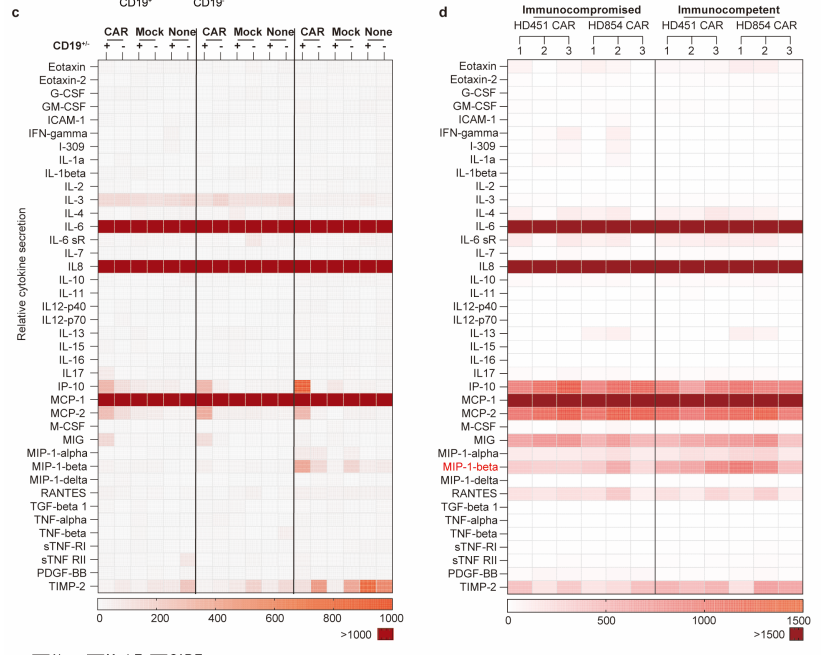
CAR T 细胞重塑微环境:scRNA-seq 显示,CAR T 细胞可诱导骨髓巨噬细胞、基质细胞等转录组改变,如基质细胞中 WARS 表达上调;
验证旁观者效应:CAR T 细胞处理组中未转导的 T 细胞激活标志物表达增强,证实该疗法的旁观者效应。
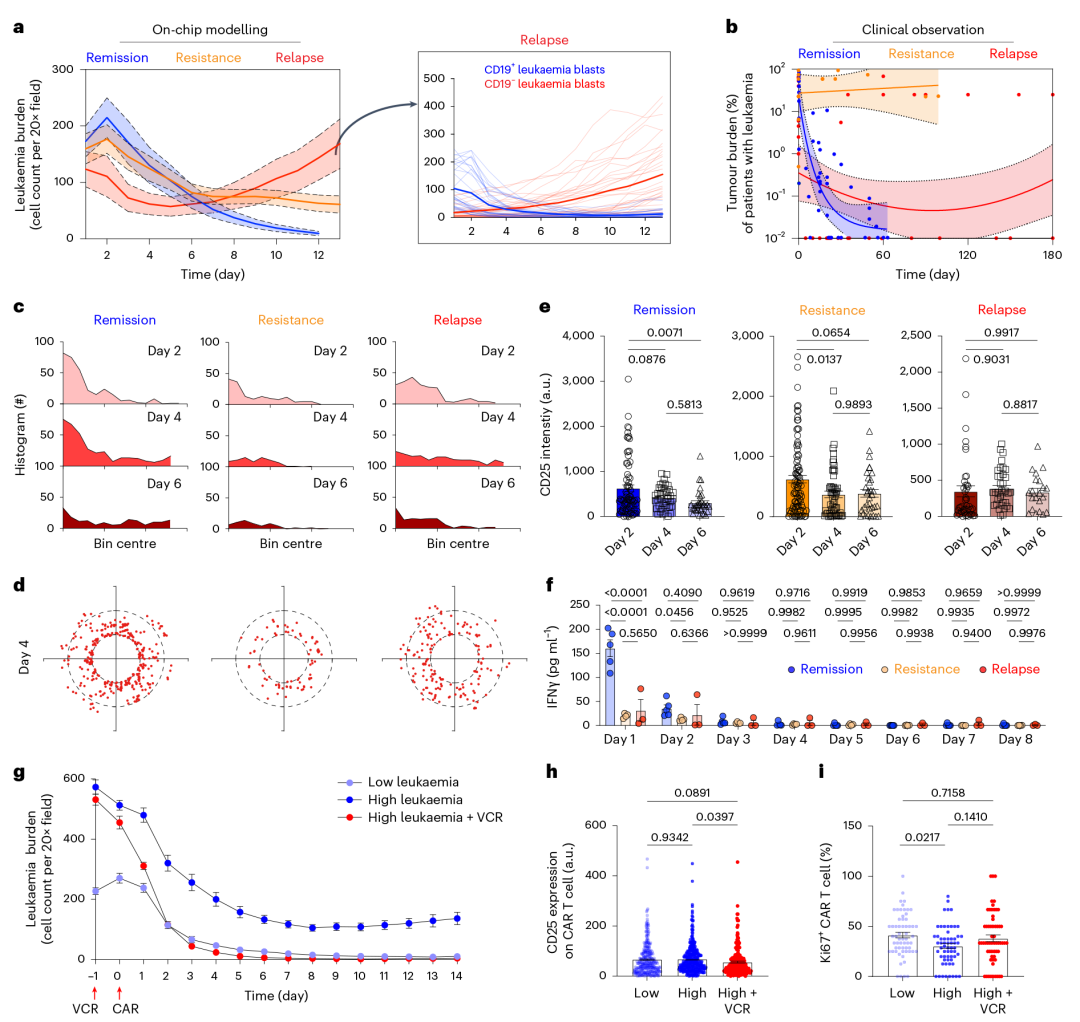
4. 模拟临床 CAR T 细胞治疗的典型应答场景(缓解、耐药、复发)
利用白血病芯片对 CAR T 细胞产品进行多维度筛选,为临床转化提供关键数据:
①耐药模型:低剂量 CAR T 细胞(2500 个 / 芯片,1:4 比例)致白血病细胞持续增殖,模拟扩增不足的治疗失败;
②复发模型:掺入 1% 或 5% CD19⁻白血病细胞,CAR T 细胞仅清除 CD19⁺细胞,CD19⁻细胞失控扩增,模拟抗原丢失复发;
③临床关联性验证:芯片各场景白血病负荷动态(缓解组降、耐药组升、复发组先降后升)与 209 例患者临床数据高度一致,还揭示传统模型难测机制(如耐药组 CAR T 细胞分布局限)。
此外,芯片验证 “桥接化疗” 价值:20nM 长春新碱预处理降初始肿瘤负荷,显著改善后续 CAR T 细胞杀伤效率与分布范围。
5. 系统评估不同 CAR T 细胞产品的功能性能
该研究以抗 CD19 第二代 4-1BBζ-CAR T 细胞为模型,在芯片中实现其时空动态监测,结果显示:3 天内以 1:1 比例杀伤约 70% 白血病细胞、7 天清除率超 99%(Mock T 细胞及未处理组无效);血管化芯片助其早期快速分布,非血管化芯片增强其晚期扩增,且能捕获其跨血管外渗与浸润过程;CAR T 细胞与靶细胞作用后,激活标志物、细胞毒性细胞因子及增殖标志物表达均升高,scRNA-seq 也证实相关功能通路激活。
1.本研究建立了3D 血管化免疫活性白血病芯片,复刻骨髓微环境与免疫特征;
2. 结合了scRNA-seq、精准蛋白质组学(RayBio抗体芯片AAH-INF-3)等多技术实时追踪 CAR-T 时空动态,解析其与微环境互作;
3. 分别模拟 CAR-T 治疗缓解、耐药、复发等多种场景,契合临床数据;
4. 评估不同 CAR-T 产品,支持患者特异性研究,助力 CAR-T 研发。