瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
破解胰腺癌免疫治疗困境!关键“钥匙”CXCR2被发现,疗效获类器官模型证实
63 人阅读发布时间:2025-12-01 16:43
杂志名称:Molecular Therapy Oncology
文章题目:Empowering pancreatic tumor homing with augmented anti-tumor potency of CXCR2-tethered CAR-NK cells
第一作者:Jong Hyeon Yoon
通讯作者:Jin-Ku Lee, Mihue Jang
作者单位:韩国科学技术研究院、首尔大学、国立癌症中心等
本研究所中所用产品:AAH-CHE-1(检测人类样本中38种微量表达因子)
实验样品类型:胰腺癌细胞系(Capan-2, AsPC-1, PANC-1)培养上清,患者来源胰腺癌类器官裂解液
研究背景
胰腺导管腺癌(PDAC)具有高度免疫抑制性的肿瘤微环境(TME),限制了CAR-NK等免疫细胞疗法的浸润与杀伤效果。尽管CAR-NK细胞在血液肿瘤中表现出良好疗效,但在实体瘤中因趋化因子介导的归巢能力不足而疗效有限。本研究旨在通过基因工程手段增强CAR-NK细胞对胰腺癌的趋化与浸润能力,特别聚焦于CXCR1/CXCR2趋化因子受体与其配体之间的相互作用。
研究结果
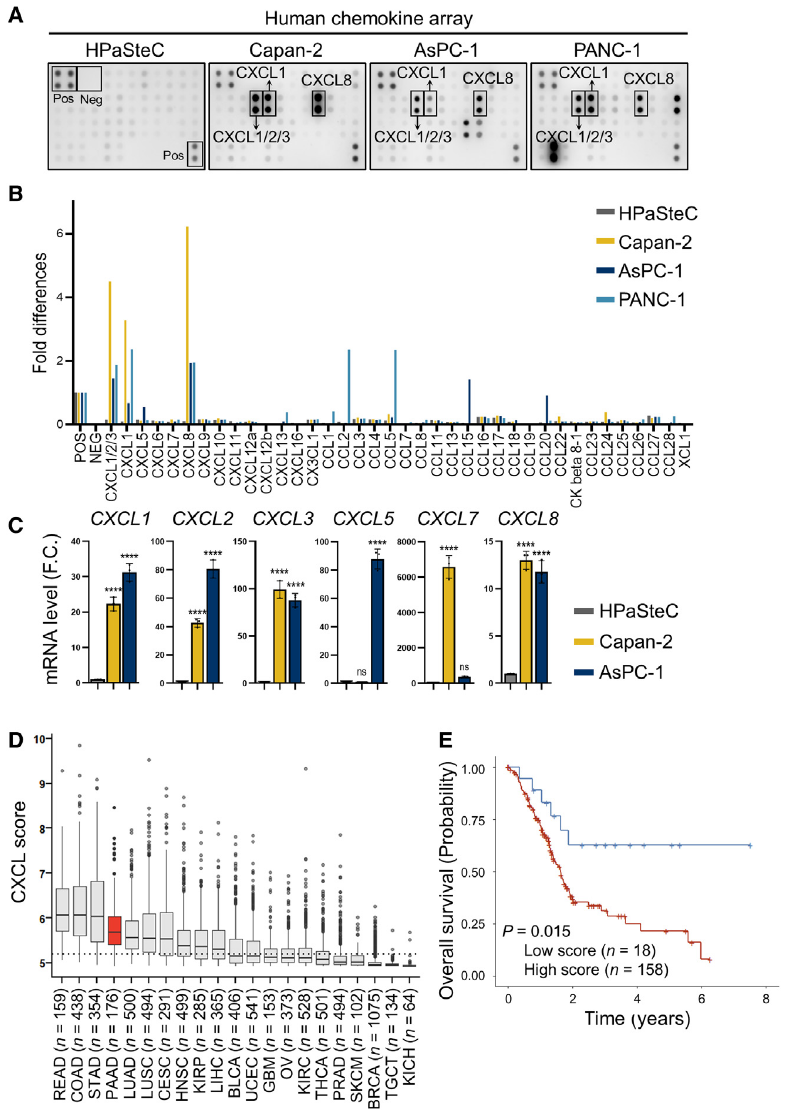
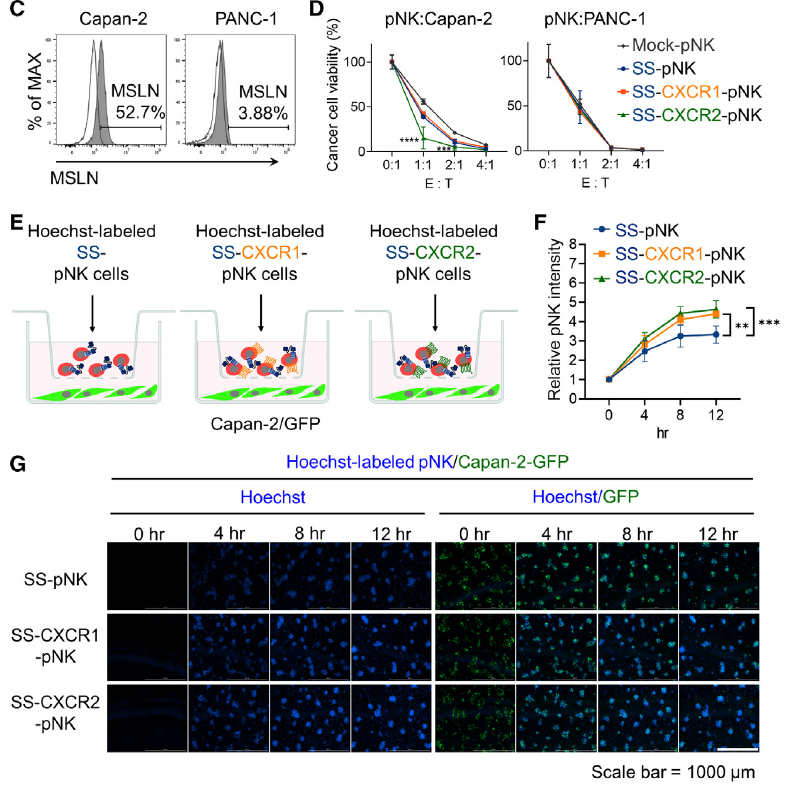
1、胰腺癌细胞高表达CXCR1/CXCR2配体
通过趋化因子专用检测芯片(AAH-CHE-1)对三种胰腺癌细胞系(Capan-2, AsPC-1, PANC-1)的培养上清进行分析,发现这些细胞高分泌CXCL1、CXCL2、CXCL3、CXCL5、CXCL7、CXCL8等CXCR1/CXCR2配体。相比之下,人原代胰腺星状细胞(HPaSteC)中这些趋化因子表达较低。TCGA数据分析进一步证实,胰腺癌中这些趋化因子高表达,且与患者不良预后相关。
2、构建CXCR1/2增强型CAR-NK细胞,CXCR1/2增强型NK细胞表现出增强的趋化能力
Transwell迁移实验显示,CXCR1/2-NK细胞对胰腺癌细胞的趋化能力显著强于对照组。使用CXCR1/2拮抗剂Navarixin预处理癌细胞后,NK细胞的迁移能力明显下降,证实趋化作用依赖于CXCR1/2与其配体的相互作用。

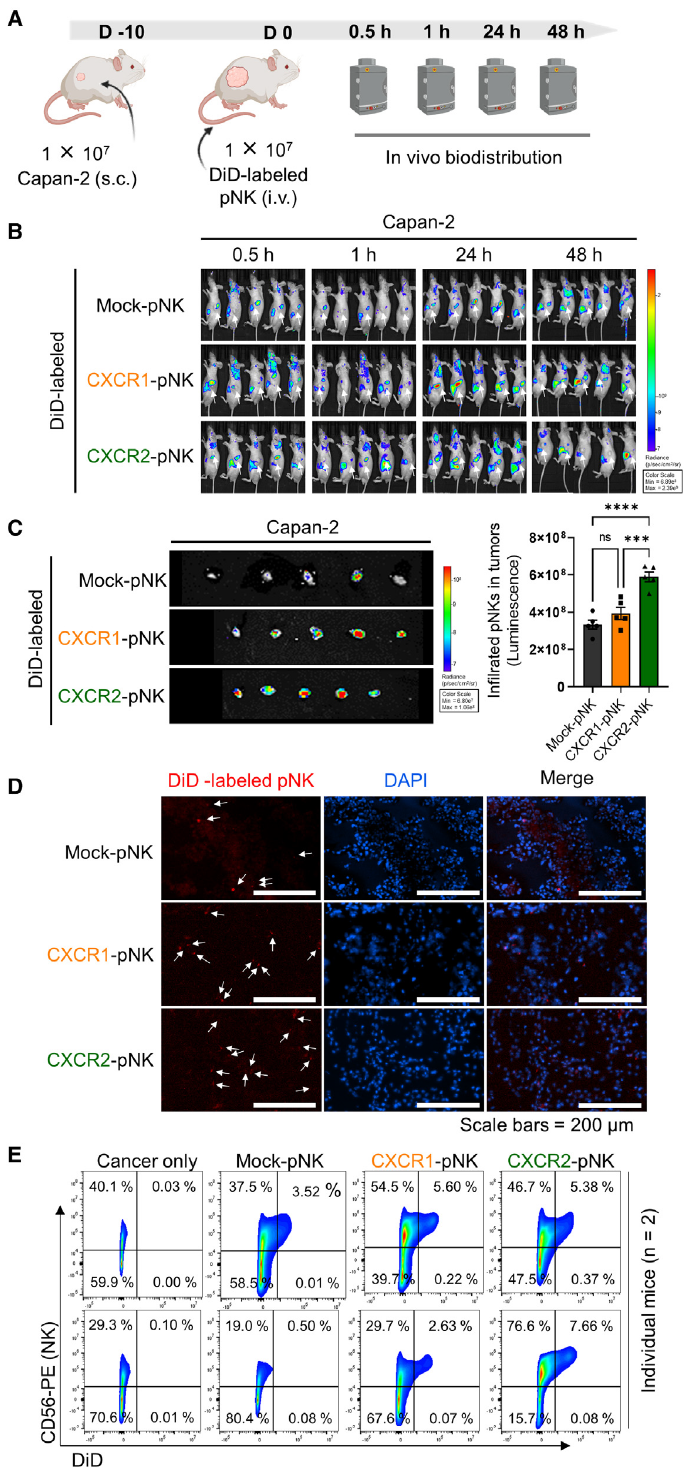
3、CXCR2-NK细胞在体内具有更强的肿瘤浸润能力
在Capan-2移植瘤小鼠模型中,静脉注射DiD标记的NK细胞后,活体成像显示CXCR2-NK细胞在肿瘤部位的富集程度最高,流式细胞术进一步证实其在肿瘤组织中的浸润数量显著多于CXCR1-NK细胞。
4、CXCR2增强型抗MSLN CAR-NK细胞具有协同抗肿瘤效果
将CXCR1/2与靶向MSLN的CAR共表达于NK细胞中,构建SS-CXCR1/2-CAR-NK细胞。体外杀伤实验显示,SS-CXCR2-NK细胞对MSLN阳性胰腺癌细胞(Capan-2)的杀伤能力最强,而对MSLN阴性细胞(PANC-1)无显著杀伤,说明其杀伤具有抗原依赖性。
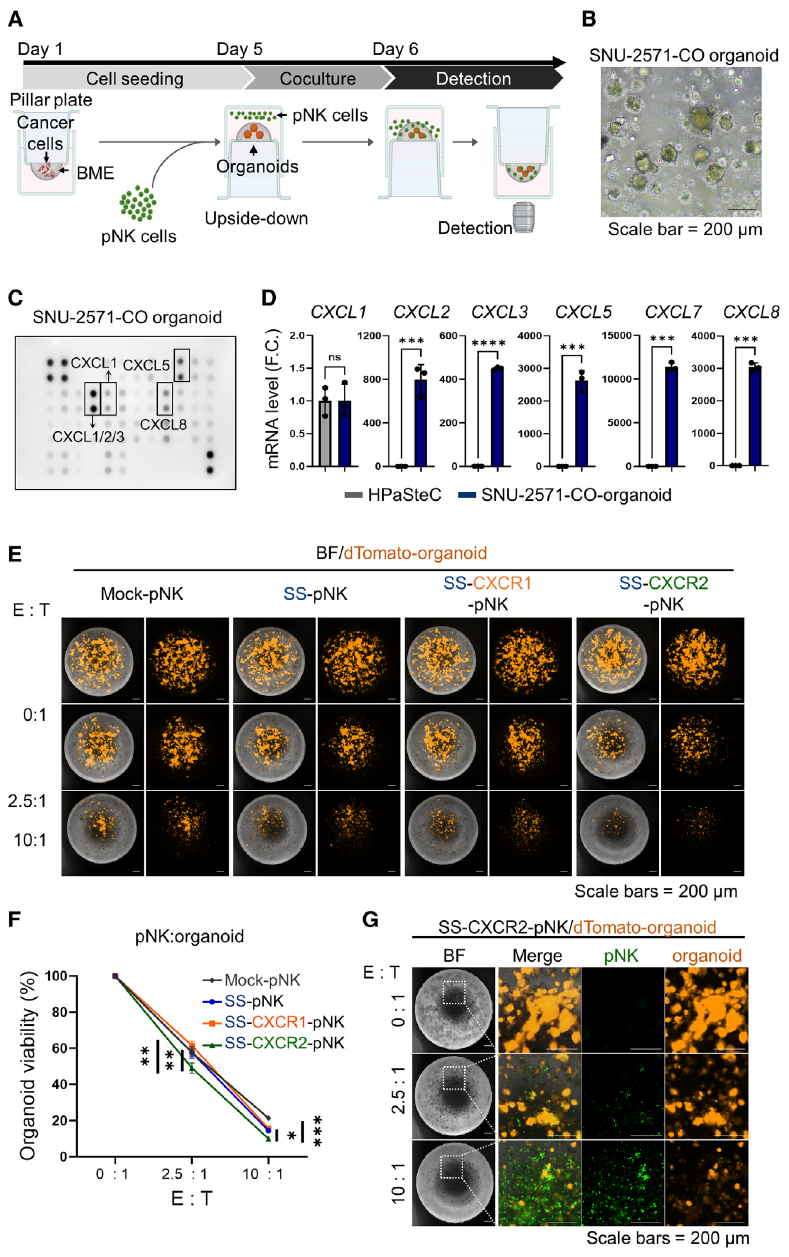
5、患者来源类器官模型中验证CXCR2-CAR-NK的优越性
为了评估CXCR2 附着型 CAR-pNK 细胞在临床应用中的可行性,研究中将三种不同的 pNK 细胞群(SS-pNK、SS-CXCR1pNK 和 SS-CXCR2-pNK)与 SNU-2571-CO 和 SNU-213-CO 患者来源的器官体(与肿瘤组织极为相似)进行了共培养,利用趋化因子专用检测芯片(AAH-CHE-1)进行类器官的趋化因子检测发现共培养后,发现类器官显著分泌或表达高水平的 CXCR1 和 CXCR2 配体,结果显示SS-CXCR2-NK细胞表现出最强的类器官杀伤能力和浸润能力,显著优于SS-CXCR1-NK和未修饰CAR-NK细胞。
研究结论
本研究系统阐明了通过基因工程手段在CAR-NK细胞中引入CXCR2,可显著增强其对胰腺癌的趋化、浸润与杀伤能力。
研究开篇就通过AAH-CHE-1芯片系统分析了胰腺癌细胞和类器官的趋化因子分泌谱,明确了CXCR1/CXCR2配体在胰腺癌中的高表达,为后续选择CXCR2作为工程化靶点提供了关键依据,最后利用AAH-CHE-1芯片再次分析共培养的类器官从蛋白角度结果表明CXCR2增强型CAR-NK细胞作为治疗胰腺癌的潜在临床策略。