瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
【IF:25】结直肠癌肝转移治疗新转机| 联合治疗新突破!SPHK1抑制剂+抗PD-1,让“冷肿瘤”变“热肿瘤”!
141 人阅读发布时间:2025-08-27 16:31
杂志名称:Cancer Communications
影响因子:24.9
文章题目:Targeting SPHK1 in Macrophages Remodels the Tumor Microenvironment and Enhances Anti-PD-1 Immunotherapy Efficacy in Colorectal Cancer Liver Metastasis
巨噬细胞靶向SPHK1重塑肿瘤微环境,增强抗pd -1免疫治疗结直肠癌肝转移的疗效
通讯作者:方媛、沈智勇
作者单位:广州南方医科大学南方医院放射肿瘤科、广东省胃肠道肿瘤精准医学重点实验室等
实验所用产品:RayBio AAM-INF-1(检测小鼠样本中40种炎症因子)
检测样本:肿瘤样本、细胞上清
研究背景
结直肠癌肝转移(CRLM)是结直肠癌患者死亡的主要原因之一,其肿瘤微环境(TME)以免疫抑制为特征,导致免疫治疗反应不佳。肿瘤相关巨噬细胞(TAMs)在调节免疫反应中发挥关键作用,但其异质性和具体机制尚不明确。鞘氨醇激酶1(SPHK1)是调控鞘氨醇-1-磷酸(S1P)代谢的关键酶,既往研究表明其在肿瘤进展中具有重要作用,但其在TAMs中的功能及其对CRLM免疫微环境的影响尚不清楚。
本研究旨在探讨SPHK1在TAMs中的作用,揭示其通过调控NLRP3炎症小体和IL-1β分泌促进CD8+ T细胞功能障碍的机制,并评估靶向SPHK1联合抗PD-1治疗的潜在疗效。
实验结果
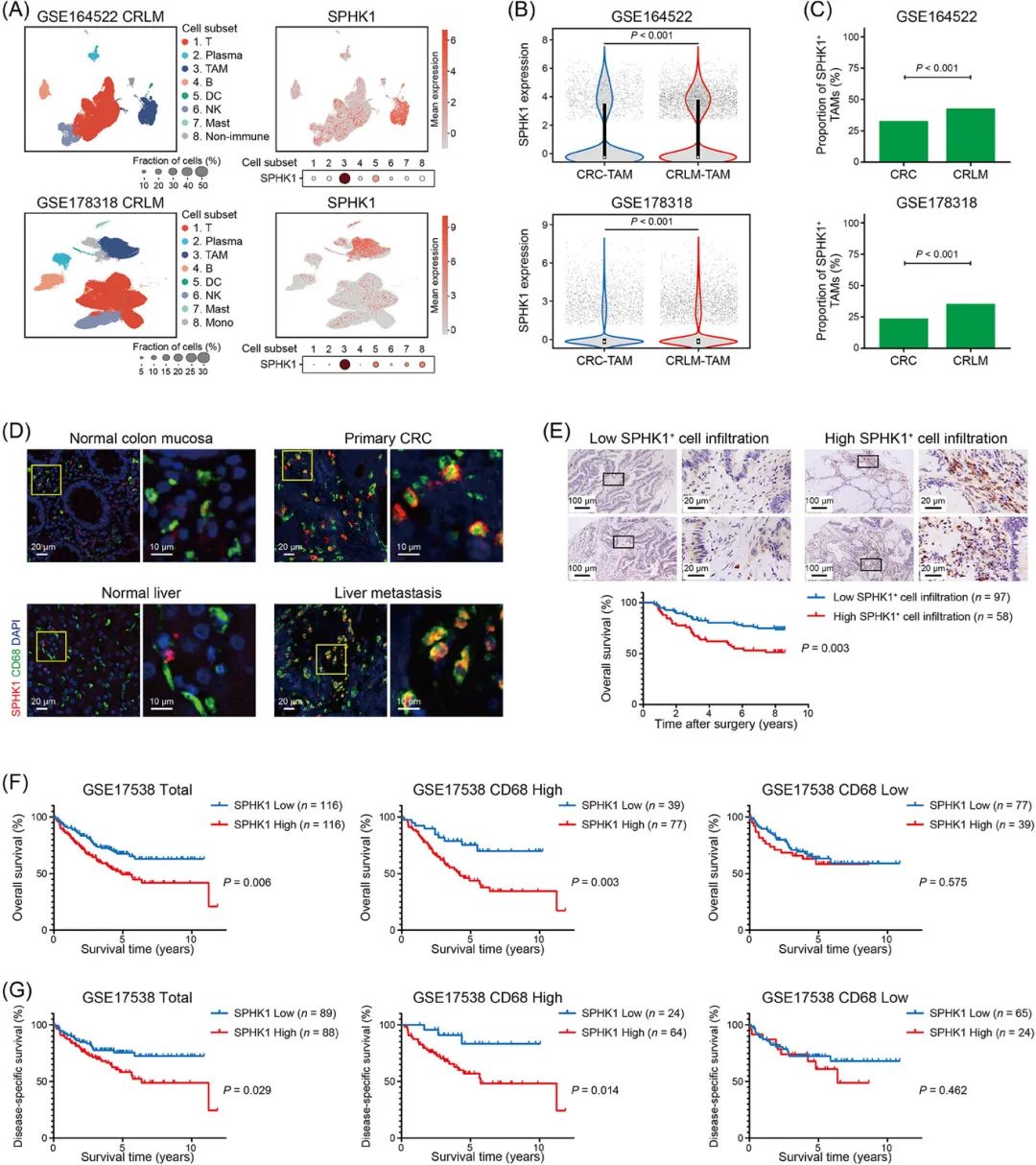
SPHK1在CRLM的TAMs中高表达且与不良预后相关
通过单细胞RNA测序(scRNA-seq)和免疫荧光分析,发现SPHK1在CRLM组织的TAMs中显著高表达(图1A-D)。
临床数据分析显示,SPHK1高表达的CRC患者总体生存率较低,尤其在CD68高表达的亚组中预后更差(图1E-G)。
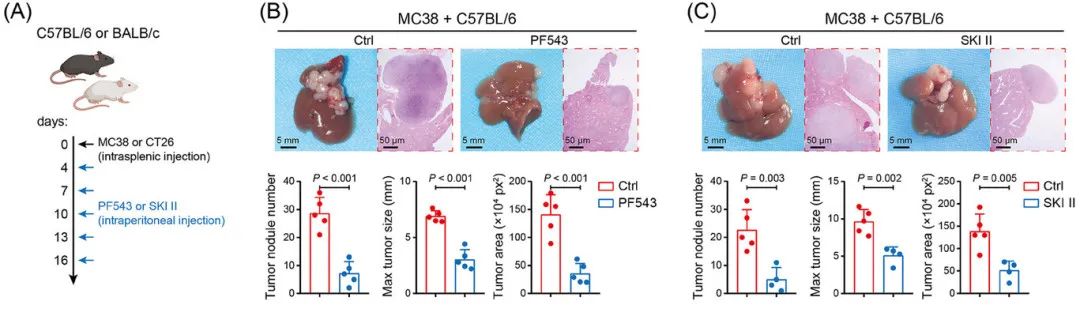
抑制SPHK1可减少肝转移并改善免疫微环境
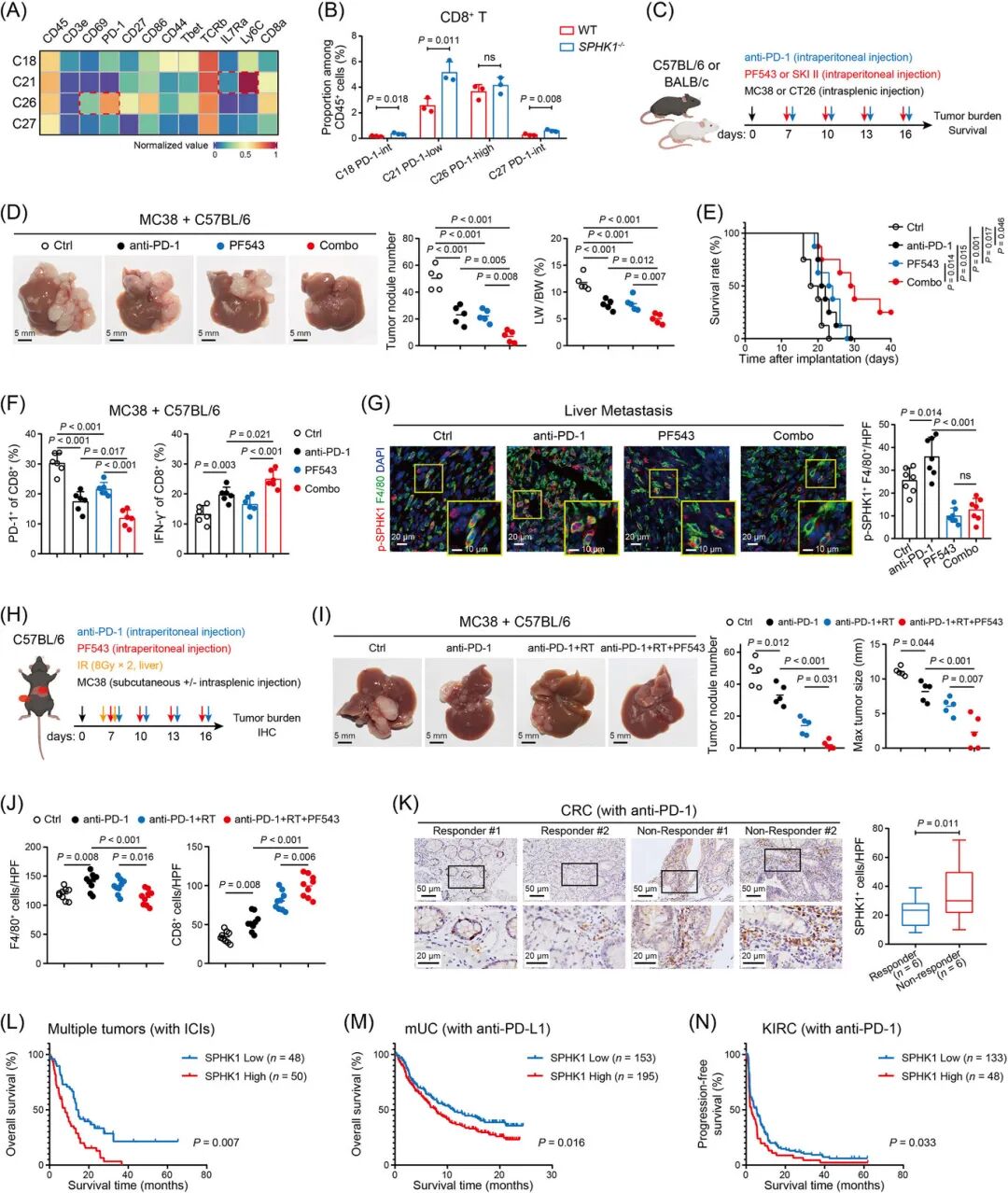
在CRLM小鼠模型中,SPHK1抑制剂(PF543、SKI II)或基因敲除(SPHK1−/−)显著减少肝转移灶数量和体积,延长生存期(图2A-J)。
质谱流式(CyTOF)和流式分析显示,SPHK1缺失导致TAMs减少,CD8+ T细胞浸润增加,且CD8+ T细胞耗竭标志物(PD-1、TIM3)下调,效应分子(IFN-γ、GZMB)上调(图3A-H)。
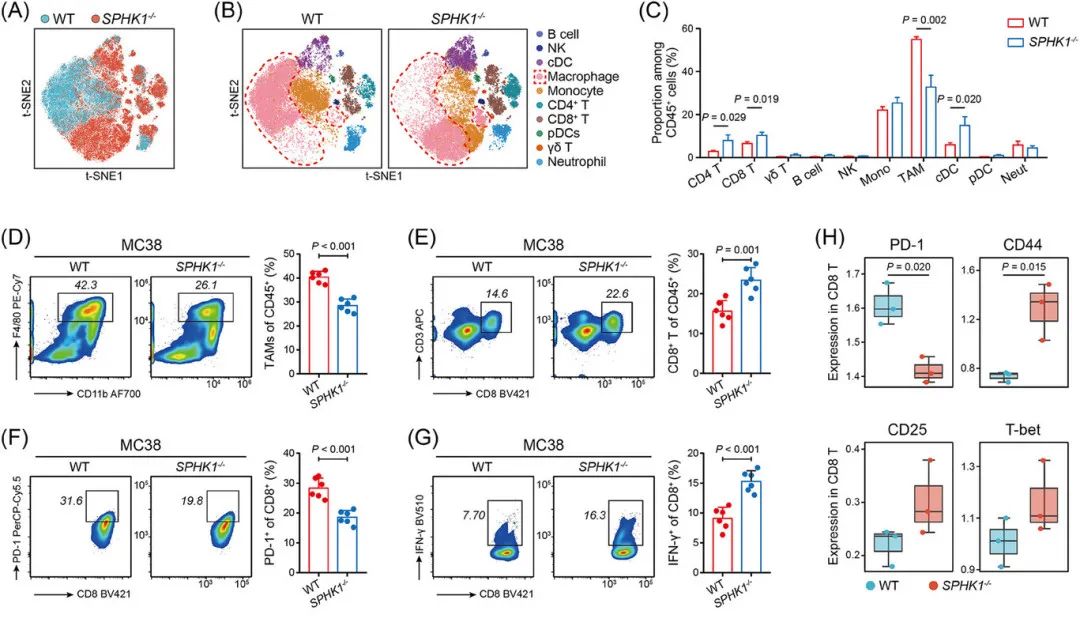
SPHK1通过S1P-S1PR2轴激活NLRP3炎症小体
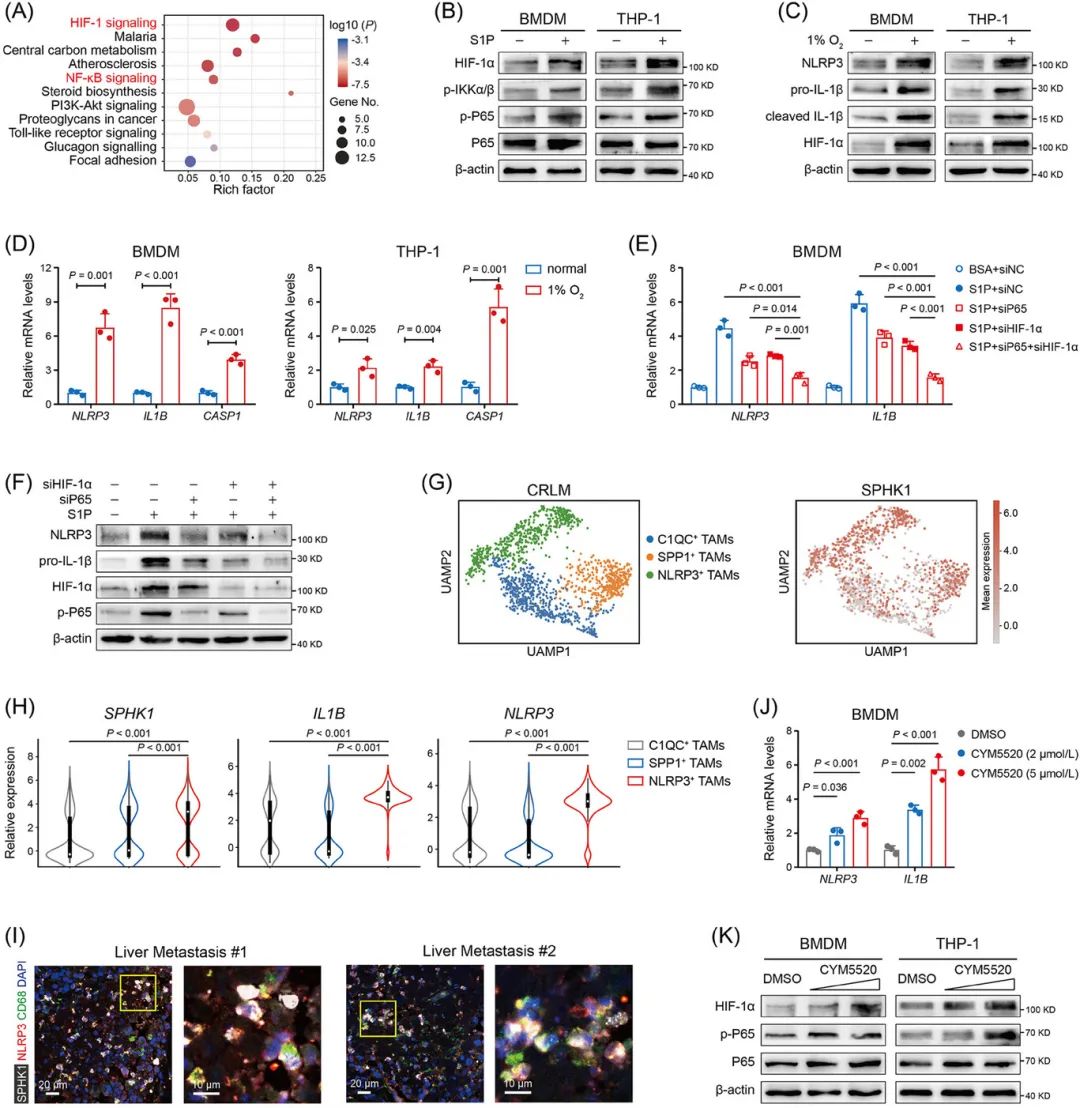
利用AAM-INF-1炎症多因子检测及RNA测序分析表明,SPHK1缺失或抑制降低NLRP3和IL-1β的表达(图4A-D)。

S1P通过结合S1PR2激活NF-κB和HIF-1α信号通路,促进NLRP3炎症小体组装和IL-1β分泌(图5A-K)。
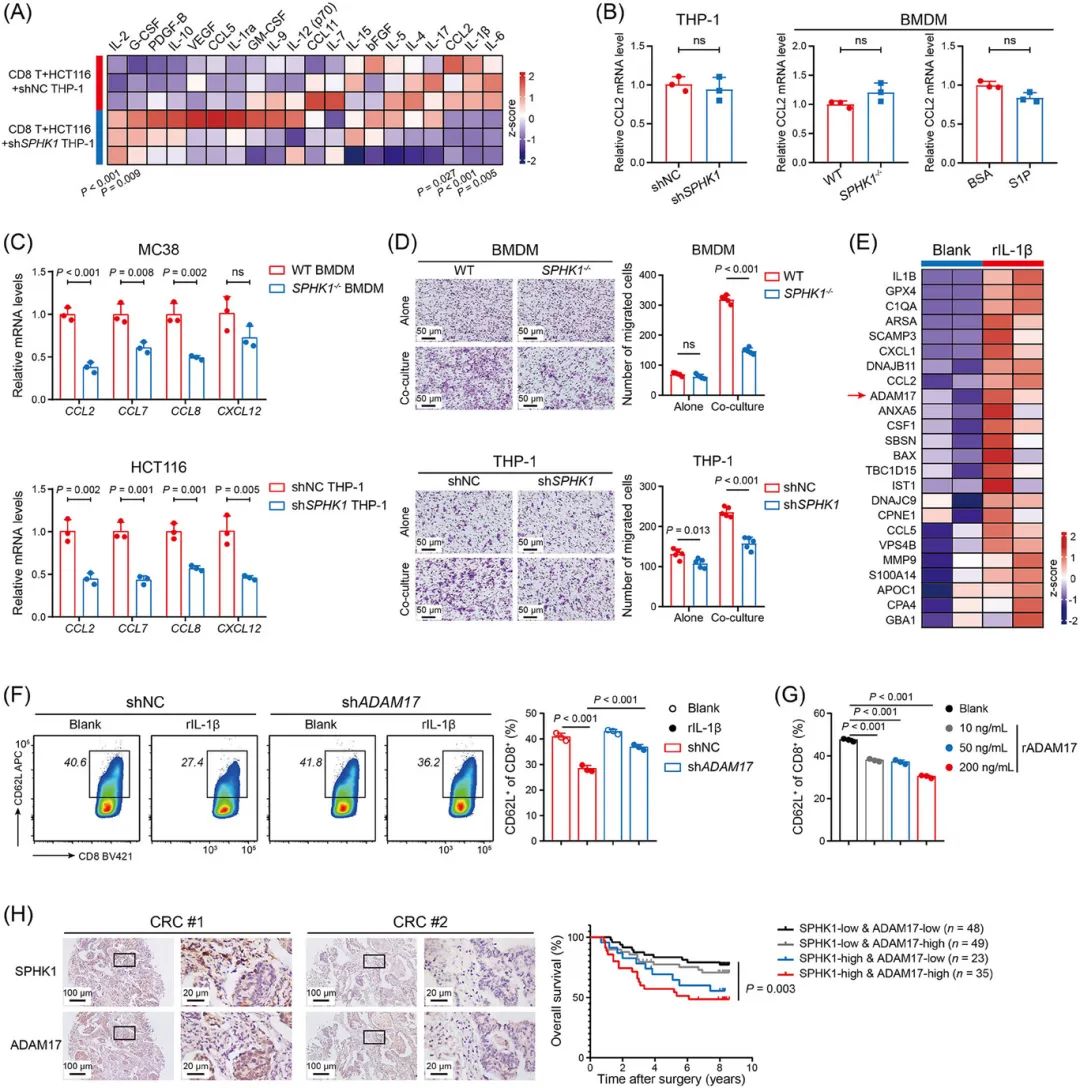
IL-1β通过ADAM17介导CD8+ T细胞功能障碍
利用AAM-INF-1炎症多因子检测IL-1β刺激的CRC细胞高表达单核细胞趋化因子(CCL2、CCL7)和ADAM17,促进TAM招募并诱导CD8+ T细胞表面CD62L丢失,加剧耗竭(图6A-H)。
临床样本中,SPHK1与ADAM17表达呈正相关,且双高表达患者预后最差(图6H)。
靶向SPHK1增强抗PD-1疗效
联合SPHK1抑制剂与抗PD-1治疗显著抑制肝转移,延长生存期,并增加CD8+ T细胞活性(图7A-G)。
在放疗联合免疫治疗模型中,SPHK1抑制剂进一步改善疗效并减轻肝损伤(图7H-J)。
临床数据分析显示,SPHK1高表达与ICI治疗耐药相关(图7K-N)。
结论
本研究阐明了SPHK1+ TAMs通过S1P-S1PR2-NLRP3-IL-1β-ADAM17轴塑造免疫抑制性TME的机制,并证明靶向SPHK1可重塑微环境、逆转CD8+ T细胞耗竭,从而增强抗PD-1疗效,研究中先后2次利用RayBio多因子炎症芯片AAM-INF-1筛选并验证SPHK1调控IL-1β及下游的ADAM17表达机制。最后联合临床验证,SPHK1作为预测ICI反应的潜在标志物和联合治疗靶点,为CRLM患者提供了新的治疗策略。