瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
猪源性胃癌模型登顶顶刊,2周精准预测抗癌药效,或终结无效化疗
400 人阅读发布时间:2025-07-31 11:12
杂志名称:Advanced Science
影响因子:14.1
文章题目:Prediction of Patient Drug Response via 3D Bioprinted Gastric Cancer Model Utilized Patient-Derived Tissue Laden Tissue-Specific Bioink
利用患者来源的组织负载组织特异性生物链接,通过生物3D打印胃癌模型预测患者药物反应
第一作者:Yoo-mi Choi
通讯作者:Charles Lee
作者单位:浦项科技大学联合梨花女子大学木洞医院
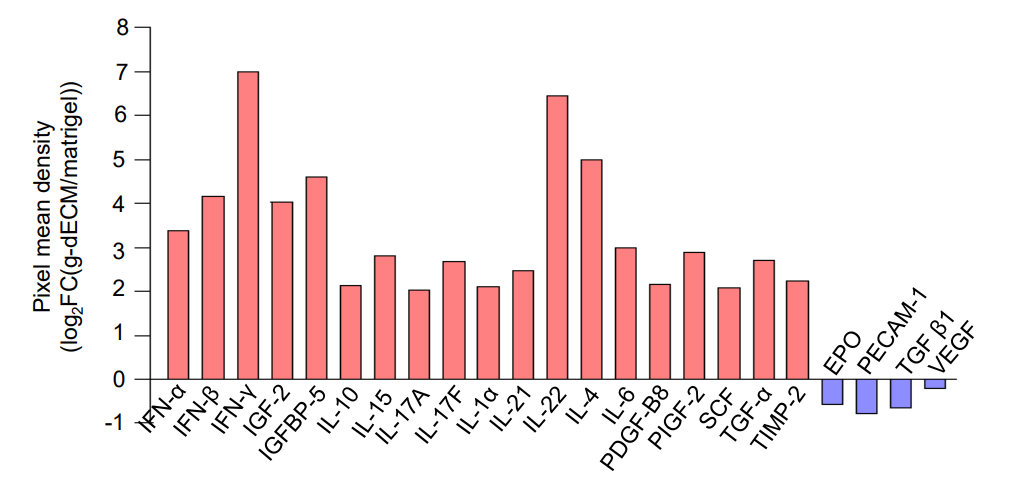
本研究所实验中所使用的产品:AAP-CYT-1(检测猪类样本中48种微量表达功能性细胞因子,涵盖炎症、免疫等信号转导关键因子)
实验样品类型:细胞裂解物
pGC模型的构建与表征
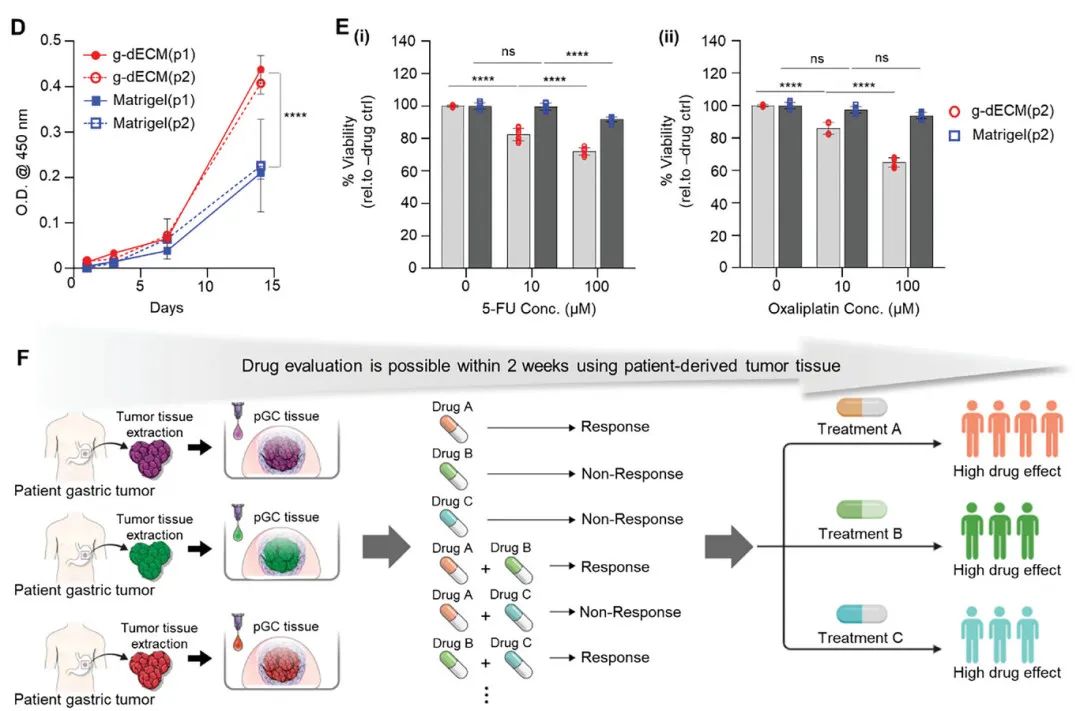
研究团队通过挤出式3D生物打印技术,将患者来源的胃癌组织与g-dECM生物墨水结合,制备了数百个pGC模型(图1A)。模型在培养7天后显示出良好的细胞活性和增殖能力(图1E, F)。组织学分析表明,pGC模型保留了原始肿瘤的组织学特征,如肠型胃癌的腺管结构和弥漫型胃癌的印戒细胞(图1G)。此外,模型中的癌细胞和基质细胞(如成纤维细胞)相互作用得以维持,模拟了肿瘤微环境(TME)的复杂性。
pGC模型的构建与表征
研究人员评估了pGC模型对常用化疗药物(5-氟尿嘧啶(5-FU)、多西他赛和奥沙利铂)的反应。结果显示,肠型和弥漫型pGC对药物的敏感性存在显著差异(图2A, B)。例如,肠型pGC对5-FU的耐药性高于弥漫型pGC,而奥沙利铂在两种模型中均表现出较高的毒性(表1)。联合用药(5-FU + 奥沙利铂)在pGC模型中显示出协同效应,进一步验证了模型的预测能力(图2D, E)。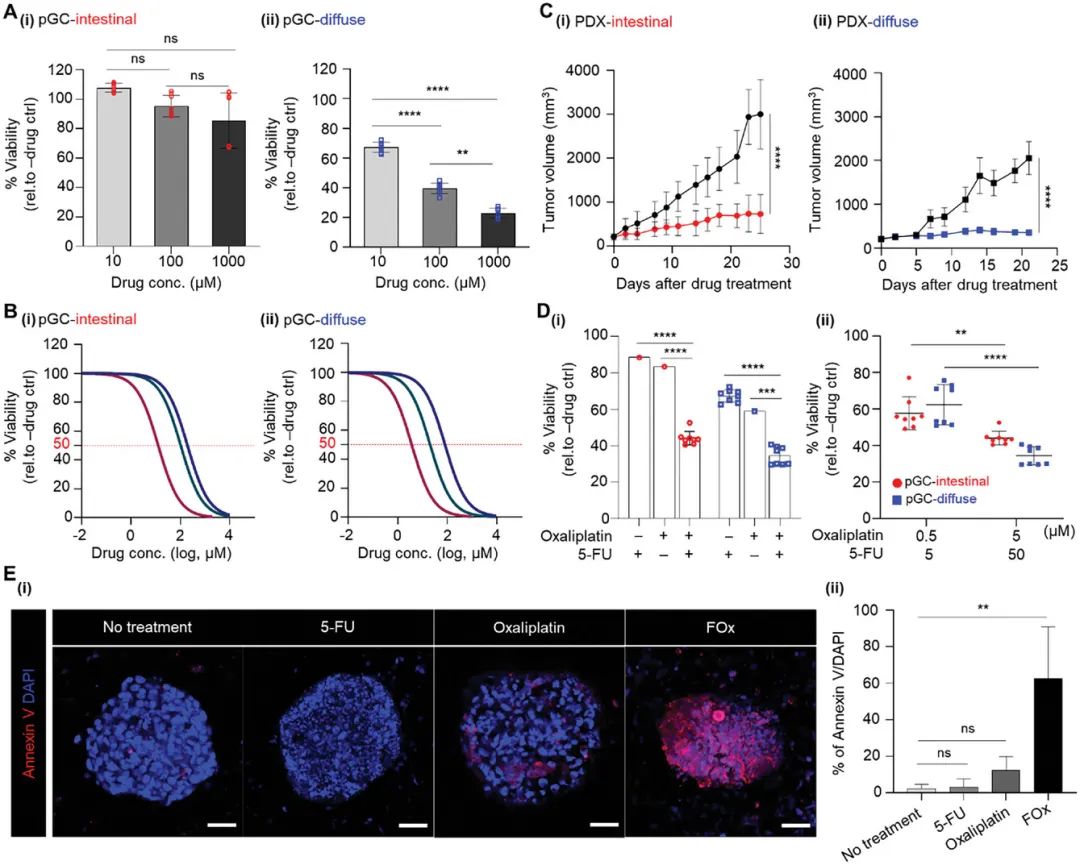
共培养模型增强药物反应预测
为模拟TME中癌细胞与基质细胞的相互作用,研究团队将pGC模型与人胃成纤维细胞(hGaFibro)共培养。共培养后,pGC对5-FU的耐药性显著增加(图3C),这与患者组织中观察到的药物反应一致。RNA测序分析显示,共培养模型中上皮-间质转化(EMT)相关基因表达上调(图3F, G),进一步证实了基质细胞在药物反应中的关键作用。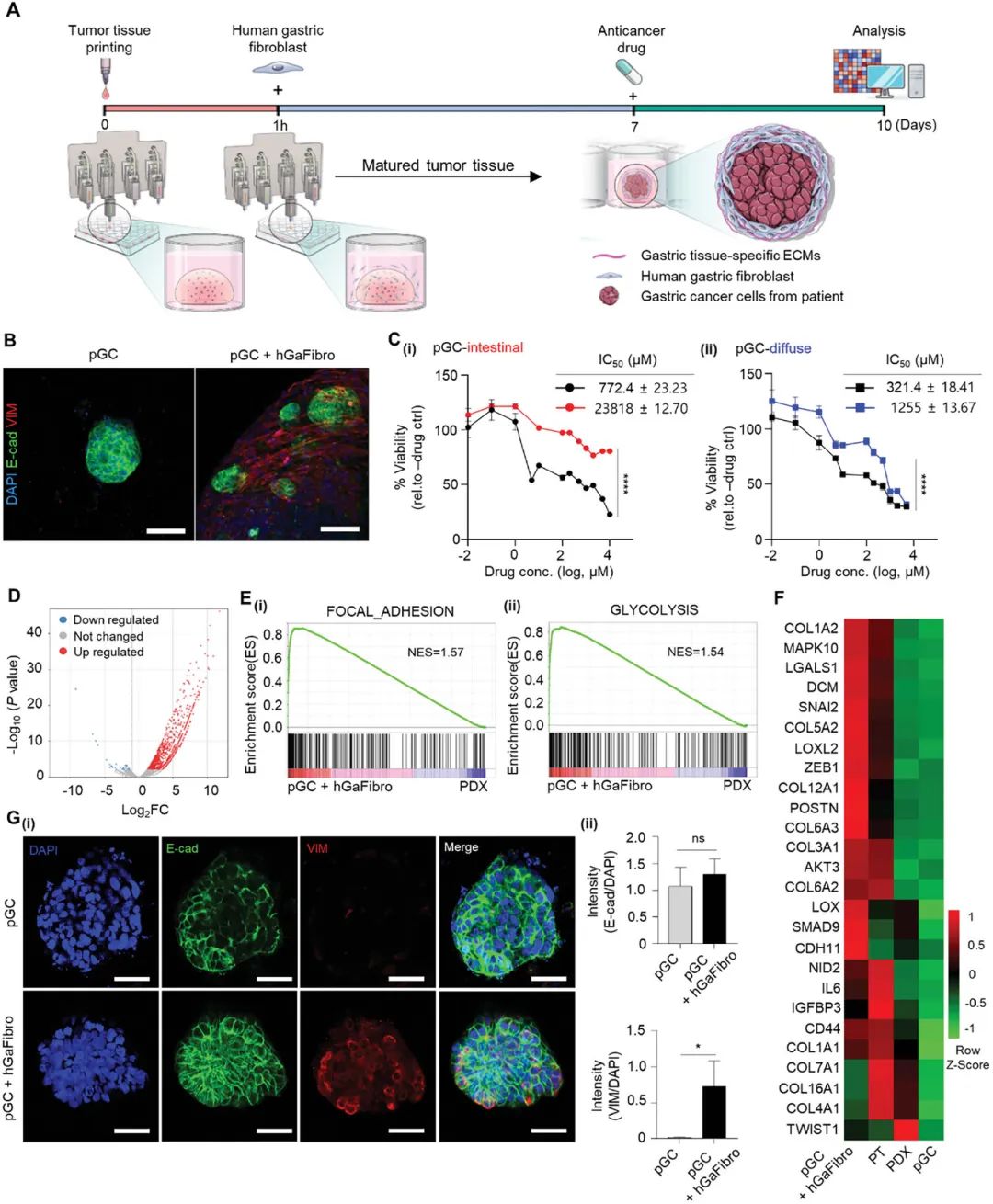
活检组织模型的验证
研究还利用患者活检组织构建了pGC模型,并比较了g-dECM与Matrigel的药物反应差异。结合多因子抗体芯片AAP-CYT-1检测,结果显示,g-dECM中的pGC模型对5-FU和奥沙利铂的敏感性更高,表明组织特异性基质在药物评估中的重要性。此外,该模型成功扩展到其他实体瘤(如胰腺癌),展示了其广泛的应用潜力。