瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
2025年《Cell》最新前沿|RayBio抗体芯片助力评估静脉注射溶瘤病毒疗法在难治性癌症中的治疗潜力
3338 人阅读发布时间:2025-03-17 14:12
溶瘤病毒(Oncolytic Virus,OV),比如腺病毒、新城疫病毒(NDV)、细小病毒和呼肠孤病毒等,作为一类能够选择性感染和杀死肿瘤细胞的病毒,同时激活宿主的抗肿瘤免疫反应,在治疗恶性肿瘤方面展现出了巨大前景。溶瘤病毒的抗肿瘤作用主要归因于其在肿瘤细胞中的优先复制和溶瘤作用,以及溶瘤后激活的免疫反应。然而,在临床实践中,溶瘤病毒面临着几大挑战,包括静脉注射安全性问题、免疫原性不足、抗病毒免疫反应等。
具体来说,溶瘤病毒在静脉注射时可能对正常组织造成损害,存在安全性问题;同时,病毒引发的免疫反应较弱,难以有效抑制肿瘤生长,即免疫原性不足;此外,病毒在体内可能引发中和抗体,导致治疗效果减弱,即抗病毒免疫反应。这些问题限制了溶瘤病毒在临床上的应用。
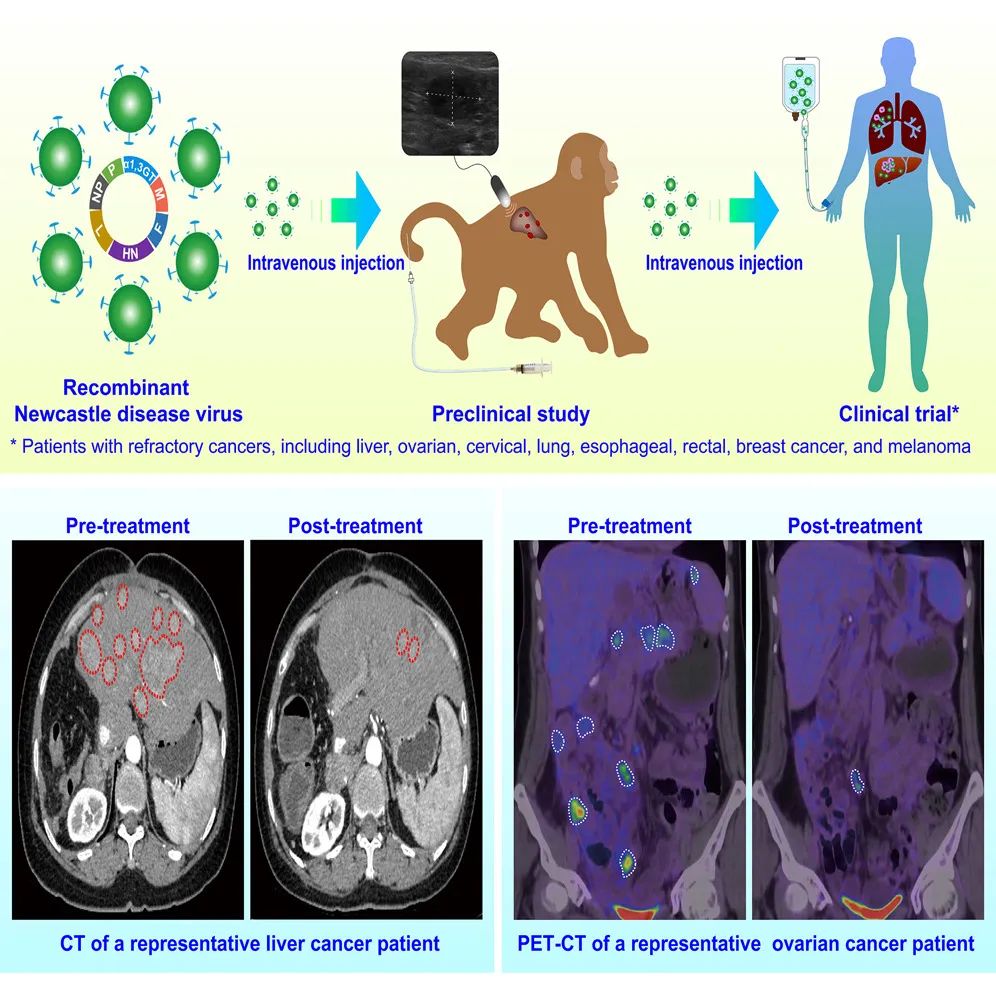
广西医科大学赵永祥教授研究团队开发了一种新型溶瘤病毒疗法,通过基因工程改造,提高了溶瘤病毒的免疫原性,增强其抗肿瘤效果,同时解决了静脉注射安全性问题。
研究思路与方法
研究思路
2.1 病毒构建与表征
研究团队利用基因工程技术,将猪源α1,3GT基因整合到NDV基因组中,构建NDV-GT病毒。通过病毒滴定、基因组测序等方法对NDV-GT进行表征,确保其遗传稳定性和生物安全性。
2.2 临床前研究
建立人肝癌异种移植模型,通过超声引导下经静脉给药的方式,将NDV-GT病毒注射到模型动物体内。
利用RayBio的蛋白芯片产品对肿瘤组织中的蛋白质表达谱进行分析,探索NDV-GT病毒的抗肿瘤机制。通过比较不同治疗组肿瘤组织中蛋白质表达水平的差异,发现NDV-GT病毒能够显著激活机体的免疫系统,促进肿瘤细胞的凋亡和清除。
对NDV-GT病毒的安全性进行评估,包括病毒检测、血常规和生化指标检测以及组织学检查等。
2.3 临床试验设计
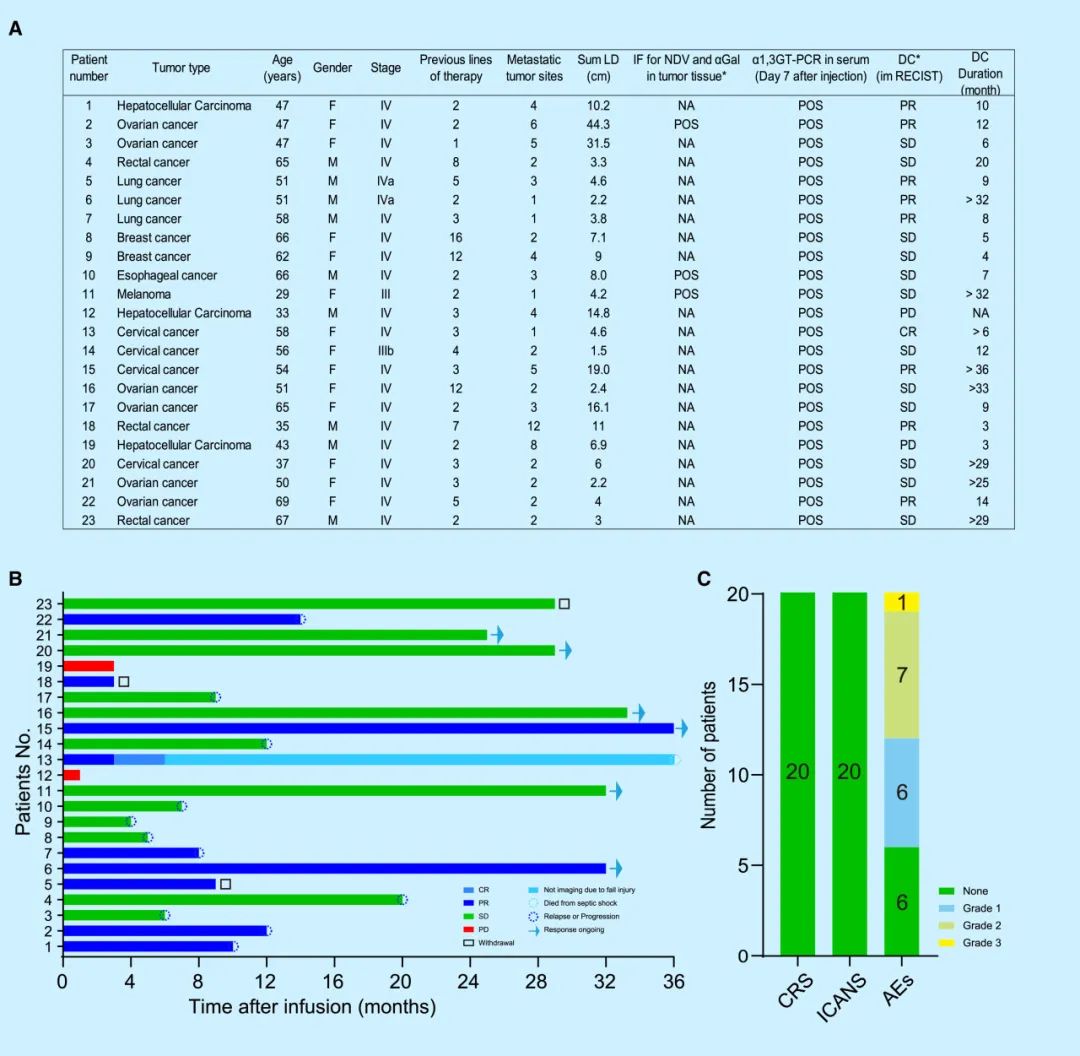
在临床前研究的基础上,研究团队发起了一项临床试验,招募了23名难治性癌症患者,包括肝癌、卵巢癌、宫颈癌、肺癌、食管癌、直肠癌、乳腺癌和黑色素瘤。这些患者每周接受一次NDV-GT静脉注射,持续8-12周。通过PET-CT、CT、MRI等影像学手段评估肿瘤的缩小情况,并使用免疫学指标评估患者的免疫反应。
细胞实验:
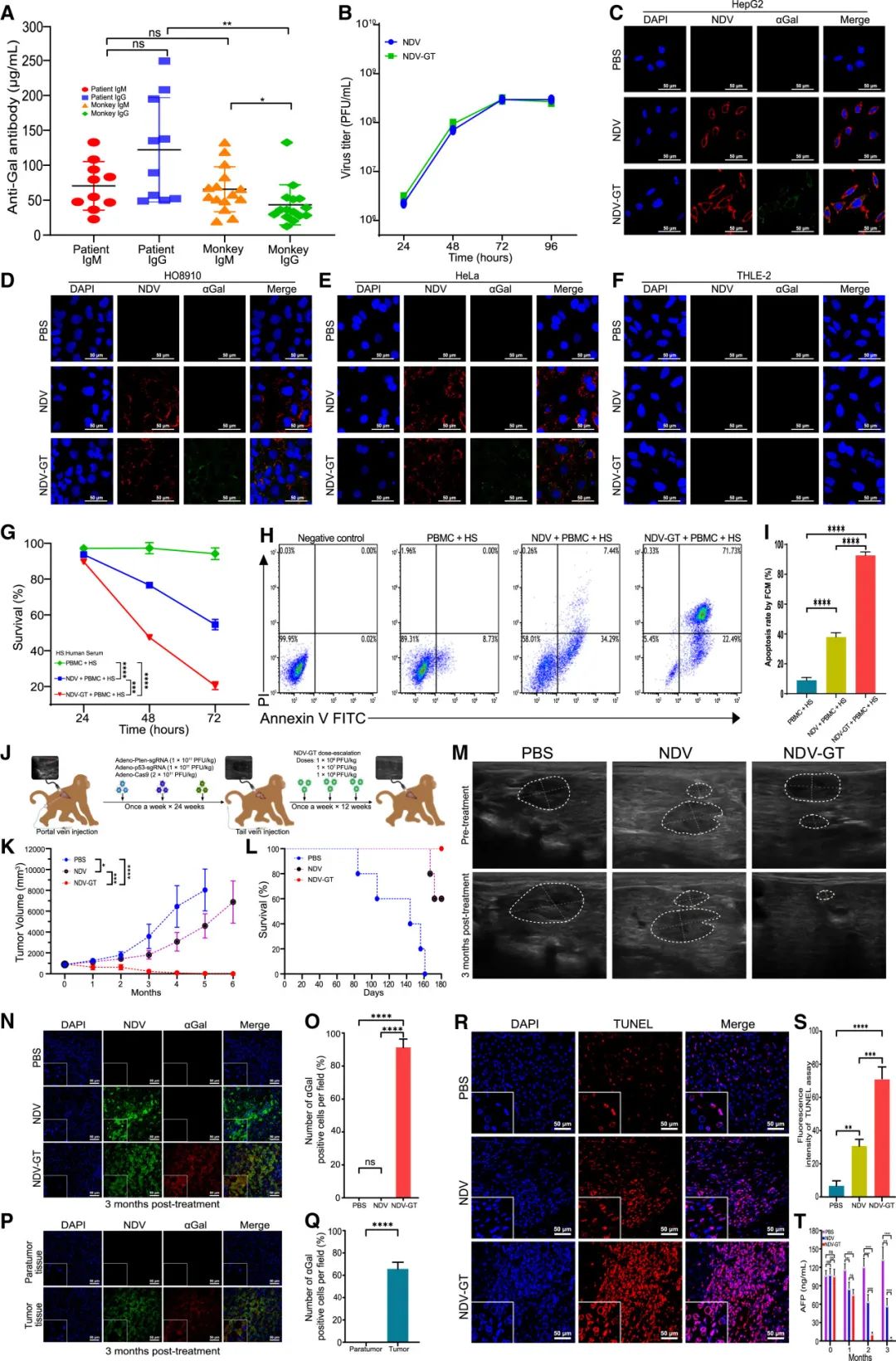
NDV-GT是通过反向遗传技术将猪α1,3-GT基因插入NDV序列生成的,经PCR和测序确认基因成功插入且保留复制能力。实验显示,NDV-GT能特异性感染多种肿瘤细胞(如HepG2、HO8910、HeLa、A549、TE-10、SK-MEL-2、MDA-MB-231、LS513等),并在这些细胞中有效表达外源性α1,3-GT基因,同时对正常肝细胞(THLE-2)感染和侵袭性极小。与亲本NDV相比,NDV-GT对肿瘤细胞(如HepG2)的增殖抑制和凋亡诱导能力更强,这归因于αGal增强的裂解能力。这些结果表明NDV-GT具有作为肿瘤治疗药物的潜力。
动物实验结果
在CRISPR诱导的食蟹猴肝癌模型中,NDV-GT(新城疫病毒-基因治疗型)展现出显著的溶瘤效果。通过肝内门静脉注射CRISPR-Cas9诱导肝肿瘤后,静脉注射NDV-GT,肿瘤内绿色荧光细胞在72小时达到峰值,96小时仍广泛分布。治疗后第三个月,NDV-GT组肿瘤显著缩小,停药3个月后肿瘤完全消失,所有猴子存活。相比之下,NDV组肿瘤生长延迟但停药后反弹,PBS组平均存活时间仅4个月。机制上,NDV-GT诱导肿瘤内血栓形成、血管闭塞及补体沉积,引发超急性排斥反应,并通过Akt-IKK-NF-kB途径介导细胞凋亡,下调相关蛋白磷酸化并上调胱天蛋白酶。这表明NDV-GT通过直接裂解肿瘤细胞、引发超急性排斥反应和激活免疫反应实现肿瘤消退。
2、临床试验结果
在23名难治性癌症患者的临床试验中,20名患者完成了治疗并进行了疗效评估。结果显示,NDV-GT治疗显著增强了患者的免疫反应,包括T细胞和树突状细胞的激活,以及多种细胞因子的分泌。在疾病控制率(DCR)方面,达到90%(1例完全缓解,6例部分缓解,11例病情稳定)。在安全性方面,NDV-GT治疗未引发严重副作用,患者的中和抗体水平虽有轻微上升,但仍在正常范围内,未影响治疗效果。
具体分为四种类型:
(1)完全缓解(CR):1例患者肿瘤完全消失,且持续4周以上无复发。
(2)部分缓解(PR):6例患者肿瘤体积缩小超过30%,且持续4周以上。
(3)病情稳定(SD):11例患者肿瘤体积缩小不超过30%或增大不超过20%,且未出现新的病灶。
(4)疾病进展(PD):2例患者肿瘤体积增大超过20%或出现新的病灶。
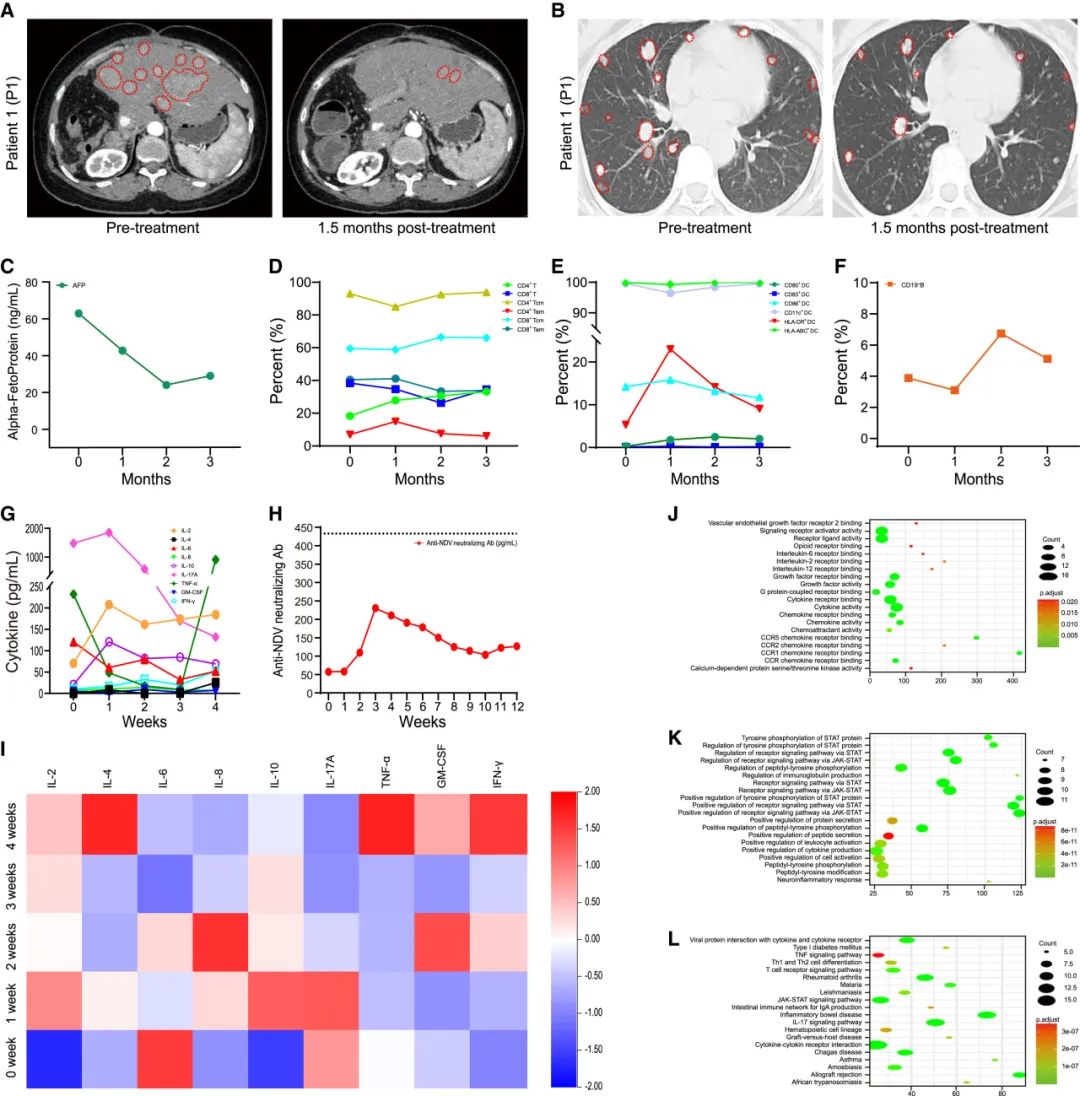
此外,研究团队还观察了NDV-GT对特定肿瘤类型的影响。以原发性肝细胞癌(HCC)为例,在接受NDV-GT治疗1.5个月后,患者体内的肿瘤结节缩小甚至消失,甲胎蛋白(AFP)水平显著降低,表明肿瘤进展受到抑制。此外,对治疗后免疫指标的分析表明,NDV-GT增强了适应性免疫,重新激活了免疫记忆系统,缓解免疫抑制或免疫逃逸,引发天然抗肿瘤免疫,并发挥体液和细胞免疫疗法(fig.5D-5F)。该治疗还促进了针对肿瘤的细胞因子分泌和免疫逃逸,而不会诱导细胞因子释放综合征(CRS)(fig.5G)。此外,NDV-GT除了炎症略有增加外,不影响血液指标或肾功能,因此表明其生物安全性。重要的是,治疗后患者血液中抗NDV中和抗体的滴度略高于治疗前,但仍在正常对照值范围内(fig.5H)。细胞因子抗体芯片(QAH-INF-3)分析进一步证实了细胞因子的激活,并揭示了激活的细胞因子参与JAK-STAT信号通路的正向调节,该通路调节病毒蛋白与细胞因子/细胞因子受体之间的相互作用(fig.5I-5L)。基于总体反应(OR)差异的生存分析表明,NDV-GT有效地治疗了快速达到PR并在10个月内保持稳定的HCC患者。
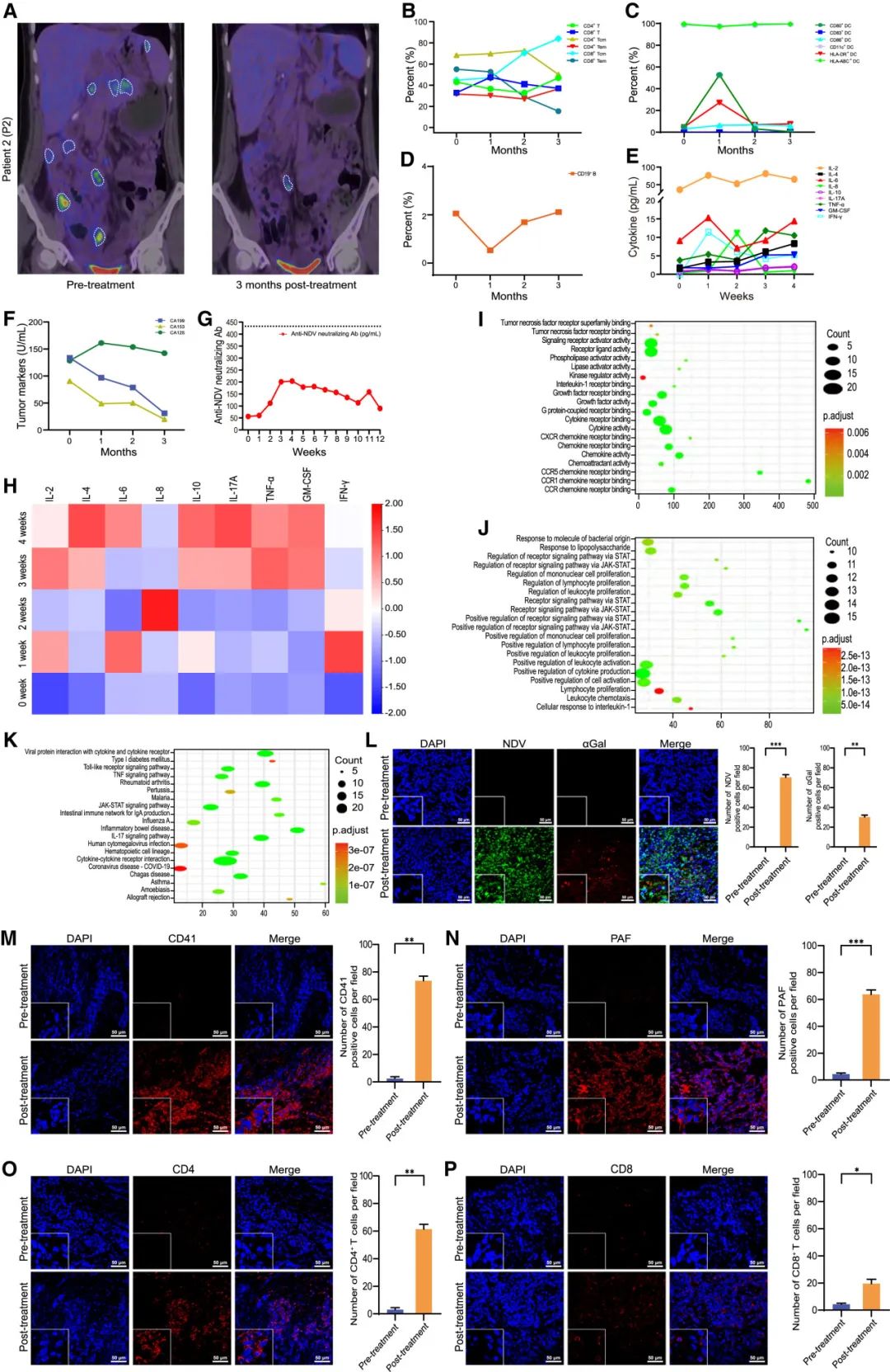
对P2卵巢癌症组织的治疗后分析显示,NDV-GT和aGal表达显著增殖(fig. 6L)。这种表达引发了超急性排斥反应,进而促进了血栓形成(fig.6M和6N)。此外,肿瘤组织中T淋巴细胞明显浸润(fig.6O和6P),导致明显的级联扩增溶瘤反应,有助于卵巢肿瘤的成功缩小甚至消失(fig.6A)。此外,根据imRECIST的评估,P2表现出持续12个月的快速PR,总生存期(OS)达到17个月。
对P2卵巢癌症组织的治疗后分析显示,NDV-GT和aGal表达显著增殖(fig. 6L)。这种表达引发了超急性排斥反应,进而促进了血栓形成(fig.6M和6N)。此外,肿瘤组织中T淋巴细胞明显浸润(fig.6O和6P),导致明显的级联扩增溶瘤反应,有助于卵巢肿瘤的成功缩小甚至消失(fig.6A)。此外,根据imRECIST的评估,P2表现出持续12个月的快速PR,总生存期(OS)达到17个月。
此外,针对恶性黑色素瘤伴淋巴结转移患者P11,在入组之前,她接受了手术治疗和靶向治疗。在接受了为期3个月的NDV-GT静脉注射后,产生了4个月的稳定期(fig.4A、4B)。随后,她接受了手术以清除剩余的转移瘤。目前,患者已稳定超过32个月。
3、机制探讨
NDV-GT能够触发超急性排斥反应,导致肿瘤血管栓塞和肿瘤坏死。同时,NDV-GT还能增强免疫反应,不仅直接溶解肿瘤细胞,还通过激活体液和细胞免疫反应,增强了抗肿瘤效果。这些机制共同作用于肿瘤细胞,实现了显著的抗肿瘤效果。
讨论
本研究开发了一种基于新城疫病毒(NDV)的基因工程溶瘤病毒NDV-GT,通过引入猪源α1,3-半乳糖基转移酶(a1,3GT)基因,诱导超急性排斥反应,显著增强抗肿瘤免疫。主要发现如下:
-
特异性溶瘤效果与安全性:NDV-GT对肿瘤细胞具有高度特异性感染和裂解能力,对正常组织影响极小,显著提高了治疗的安全性和有效性。
-
超急性排斥反应与免疫增强:NDV-GT通过在肿瘤细胞表面表达αGal抗原,触发超急性排斥反应,激活免疫系统,通过CDC和ADCC机制增强抗肿瘤免疫,实现肿瘤抑制甚至清除。
-
临床试验的积极结果:在多种难治性癌症患者的临床试验中,NDV-GT表现出良好疗效和安全性,疾病控制率达90%,部分患者实现CR或PR,未观察到严重不良事件。
尽管NDV-GT展现出显著抗肿瘤效果,但仍面临挑战:需优化生产工艺和质量控制,提高稳定性和生物安全性;探索与其他免疫疗法的联合应用;开展更大规模临床试验以验证其在更多癌症类型中的疗效和安全性。这些工作将为溶瘤病毒疗法的发展提供新思路,为肿瘤治疗带来新希望。
文献:Zhong L, Gan L, Wang B, Wu T, Yao F, Gong W, Peng H, Deng Z, **ao G, Liu X, Na J. Hyperacute rejection-engineered oncolytic virus for interventional clinical trial in refractory cancer patients. Cell. 2025 Jan 17.