瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
IF20+!暨南大学/上交大团队揭示骨关节炎新元凶:线粒体囊泡“快递”mtDNA激活炎症风暴
12 人阅读发布时间:2026-01-12 15:50
近年来,线粒体衍生囊泡(MDVs)——一种从线粒体膜上芽生、携带特定线粒体成分的纳米级囊泡,已从一种细胞质量控制机制,迅速演变为细胞间通讯和疾病信号传递的热点载体。它如同一把双刃剑,既可传递保护性信号,也暗含驱动病理的潜能。
由上海交通大学医学院附属新华医院骨科、暨南大学等单位合作完成的研究,精准切入骨关节炎(OA)这一重大临床难题,首次系统揭示了髌下脂肪垫间充质干细胞(IPFP-MSCs)来源的MDVs,通过选择性包装并递送线粒体DNA(mtDNA)至软骨细胞,激活胞内cGAS-STING先天免疫通路,从而直接驱动OA炎症与退变的全新机制。

杂志名称:Bioactive Materials
影响因子:20.3
文章题目:Extracellular vesicles from IPFP-MSCs trigger osteoarthritis by transferring mtDNA
第一作者:利时雨,晏紫,支新旺,郑蔚晗
通讯作者:张冰,赵建元,刘晗,苏佳灿
作者单位:上海交通大学医学院附属新华医院骨科、暨南大学医学院免疫学系老年免疫学研究所、上海大学转化医学研究所等
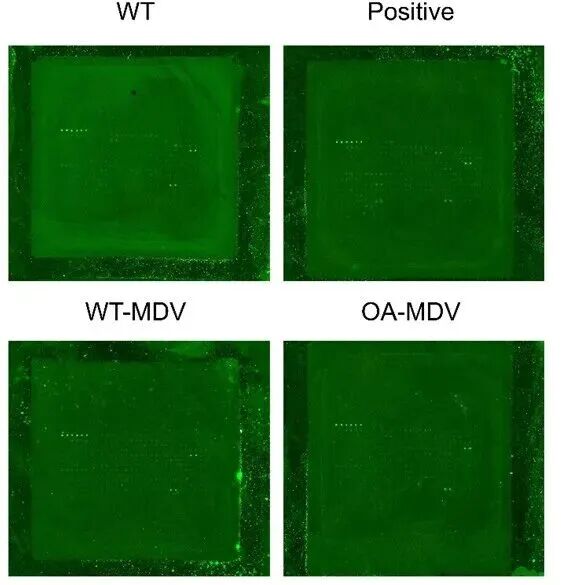
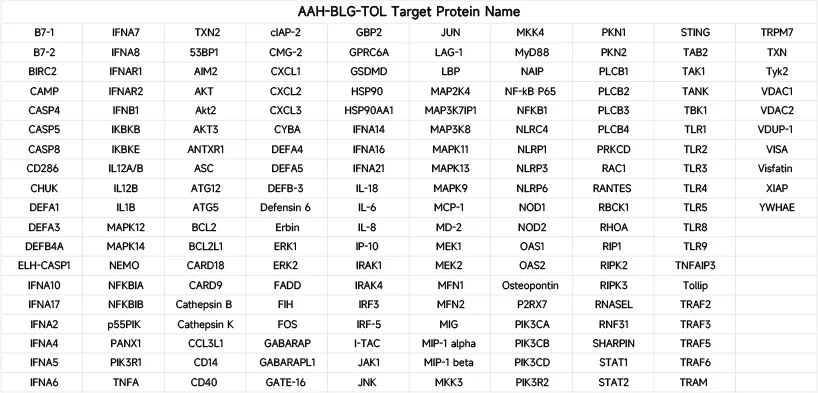
本实验所用产品:AAH-BLG-TOL(检测人类样本中181个炎症及Toll/NOD-like 受体通路相关因子)
检测样本:线粒体衍生囊泡(MDVs)共培养的软骨细胞
研究背景:
骨关节炎(OA)是一种常见的慢性关节疾病,以软骨退化、滑膜炎症和骨质改变为特征。近年来,髌下脂肪垫间充质干细胞(IPFP-MSCs)来源的细胞外囊泡(EVs)在OA发病机制中的作用备受关注。尽管已有研究提示EVs参与OA进展,但不同EV亚群的作用机制尚不明确。本研究旨在揭示IPFP-MSCs来源的线粒体衍生囊泡(MDVs)通过传递线粒体DNA(mtDNA)激活cGAS-STING通路,从而促进OA发展的分子机制。
研究结果
1、样本收集与EVs分离,单细胞追踪MDVs来源
从OA患者和创伤患者(对照组)的滑膜液中分离EVs,并通过纳米粒子追踪分析(NTA)、透射电镜(TEM)和WB分析表征。结果显示OA患者滑膜液中EVs数量显著增加,且富含线粒体标记蛋白TOMM20,提示MDVs亚群增多。
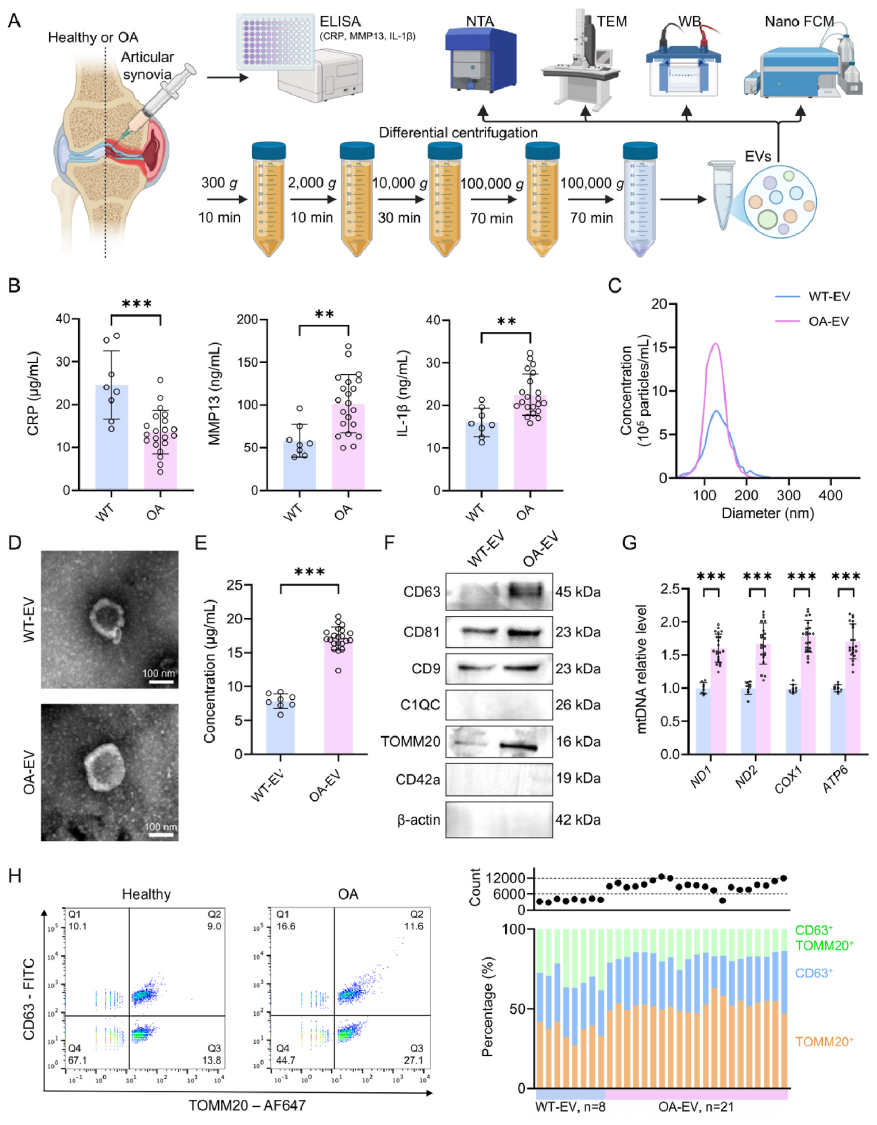
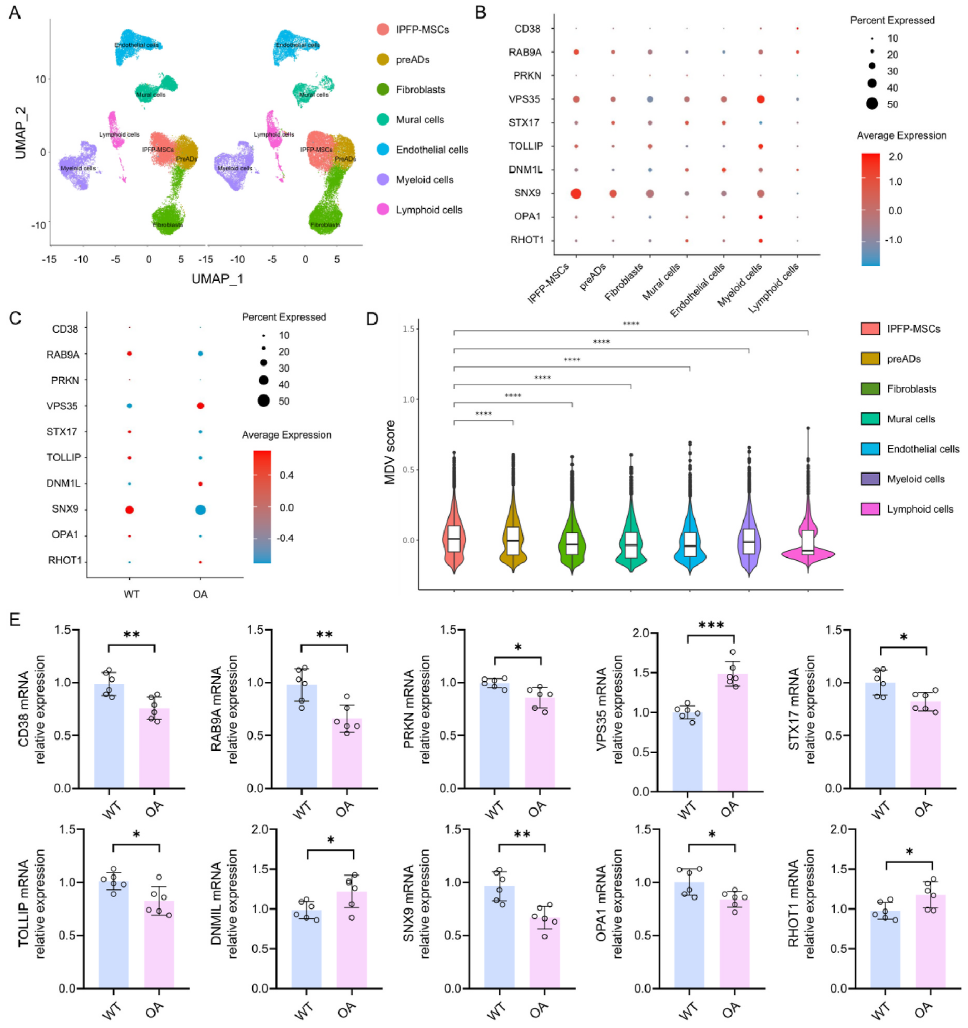
单细胞RNA-seq分析显示,VSP35 表达与 MDV 数量之间存在一致的规律关系,OA患者IPFP-MSCs中MDV生成相关基因(如VPS35)表达上调,提示IPFP-MSCs是滑膜液中MDVs的主要细胞来源。
2、MDVs体外培养及功能验证
OA患者关节置换术和创伤患者手术中提取IPFP组织,建立了IPFP-MSCs的培养体系提取MDVs,并通过IF、FC、纳米颗粒追踪分析(NTA)、WB等实验进行标志物、表型的鉴定,并发现OA组的MDVs数量更多,mtDNA更丰富,提示其可能通过激活靶细胞中的DNA感知通路参与OA病理过程。
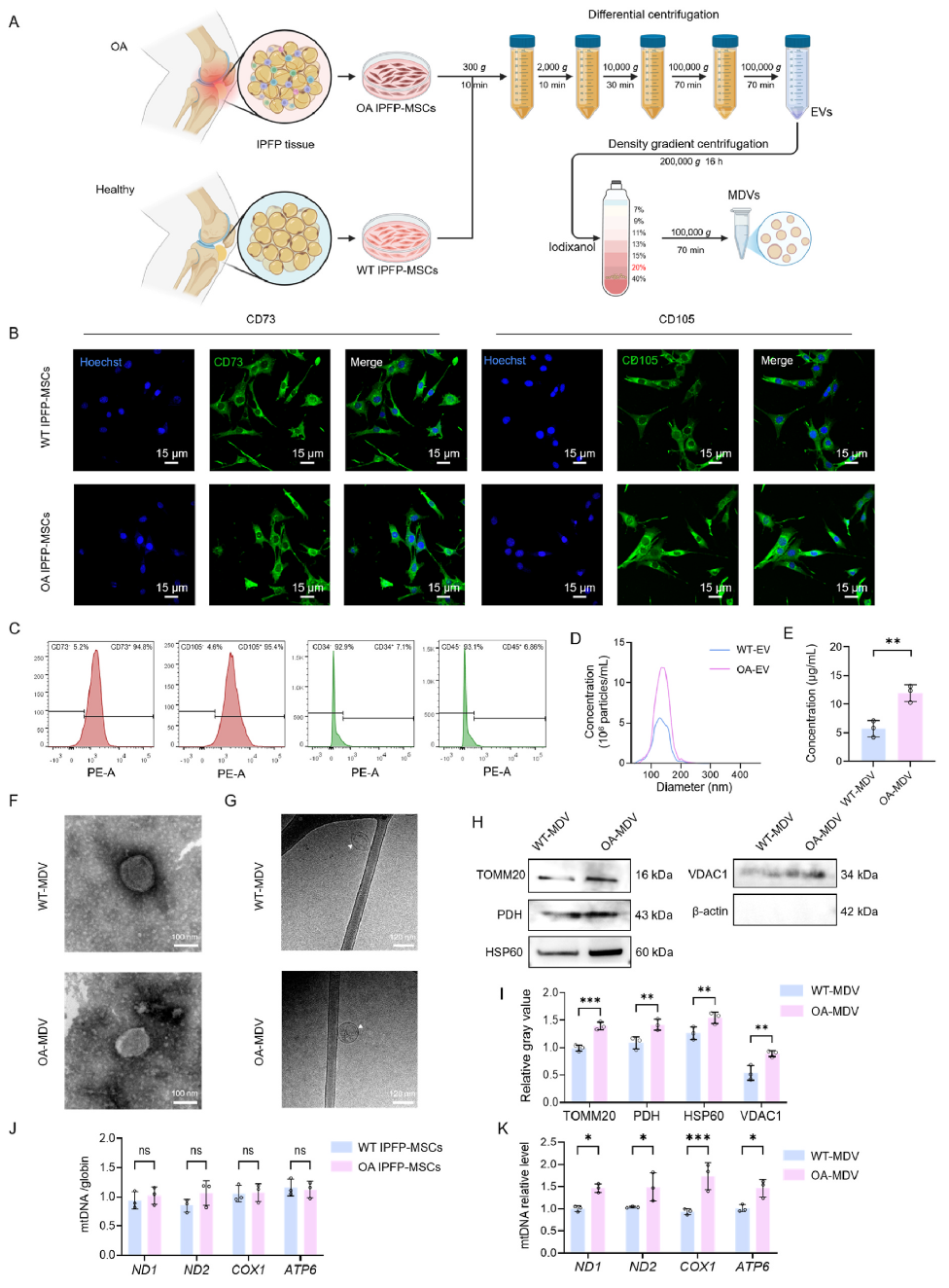
质谱分析后发现OA来源的MDV则富集外膜蛋白、凋亡相关蛋白及DNA损伤应答蛋白,具有更强的促炎和促凋亡潜能。反映了线粒体在不同应激状态下的“选择性包装”机制。
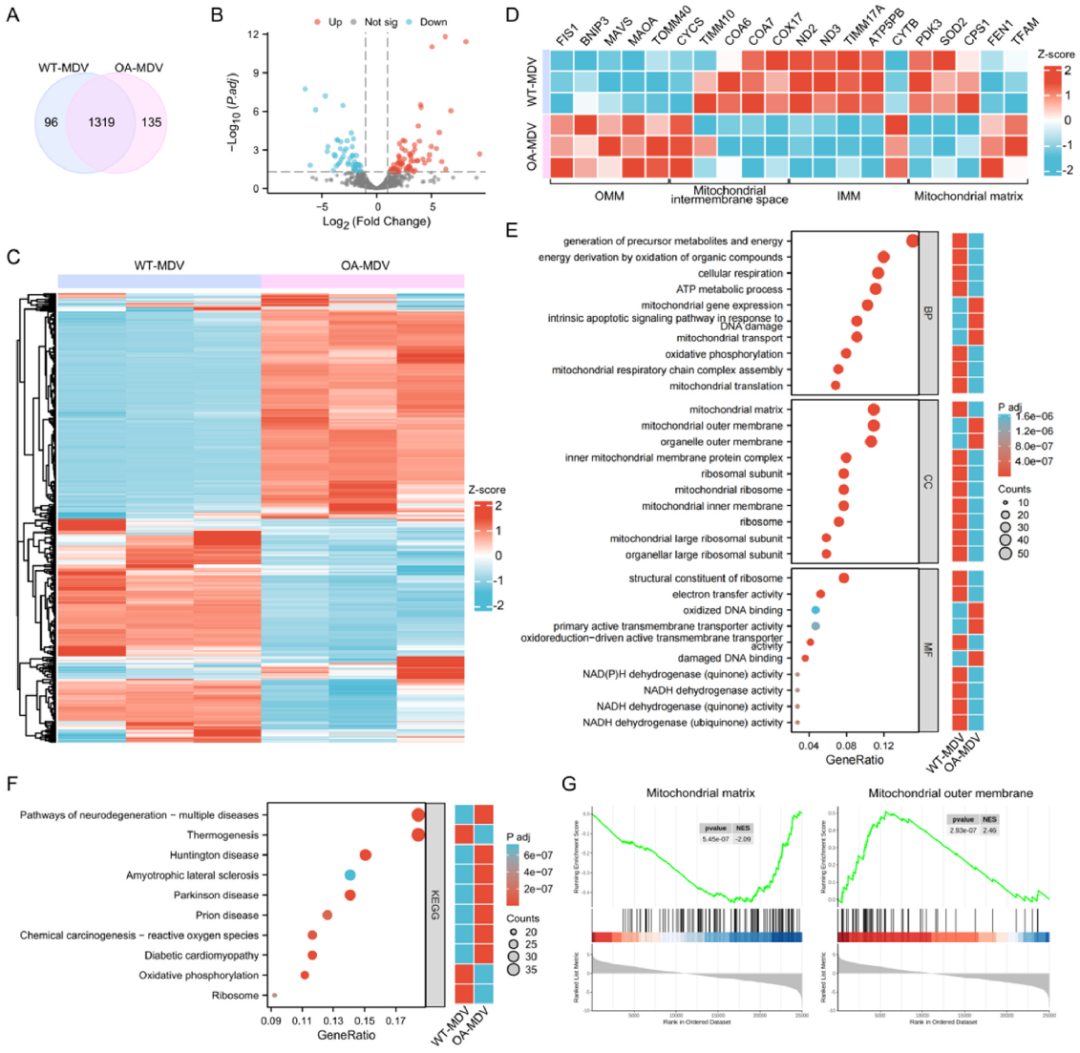
将OA-MDVs与C28/I2软骨细胞体外共培养后,PKH26荧光标记及内吞和膜融合抑制实验对比后表明OA-MDVs主要通过吞噬和直接膜融合进入软骨细胞;免疫组化及qPCR结果显示OA-MDV处理后显著抑制软骨基质合成、下调关键转录因子、促进肥大化和降解表型,加剧OA软骨退变。
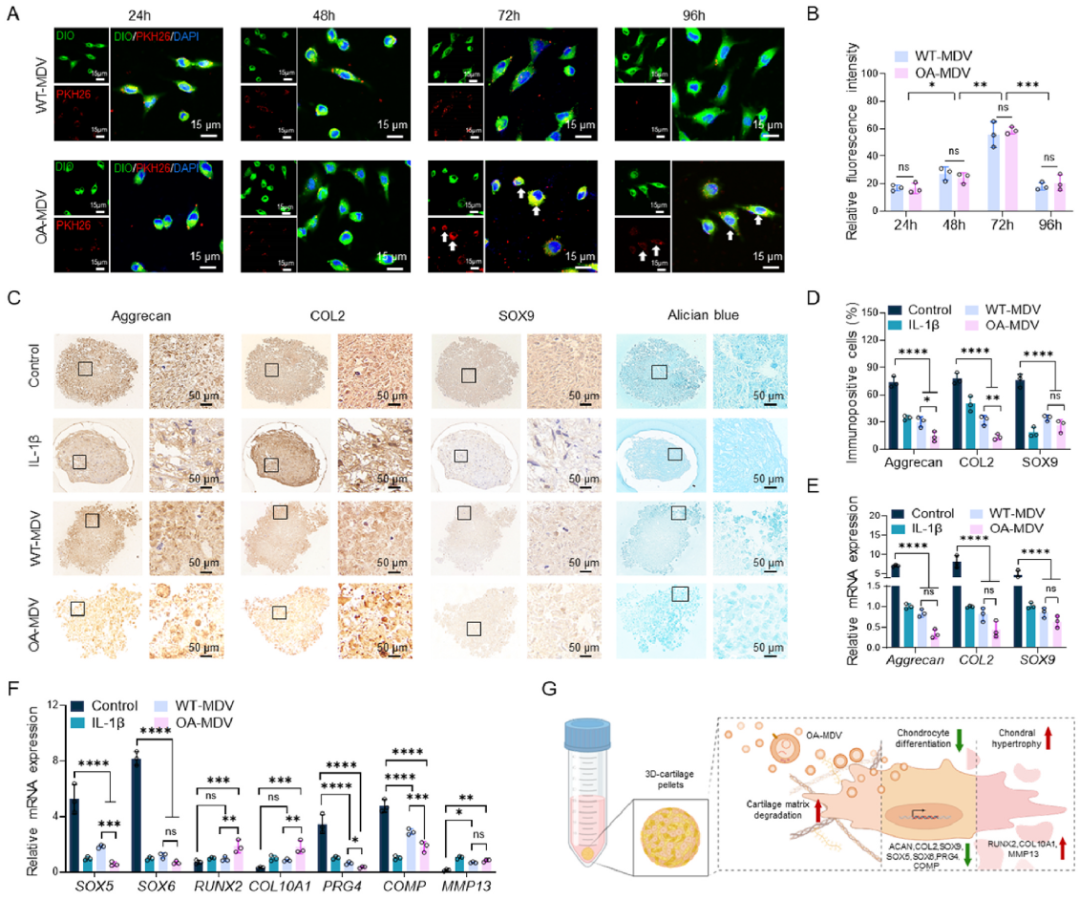
ROS水平检测及能量代谢分析发现显示OA-MDVs诱导线粒体氧化加剧,结构异化,糖酵解代偿增强。
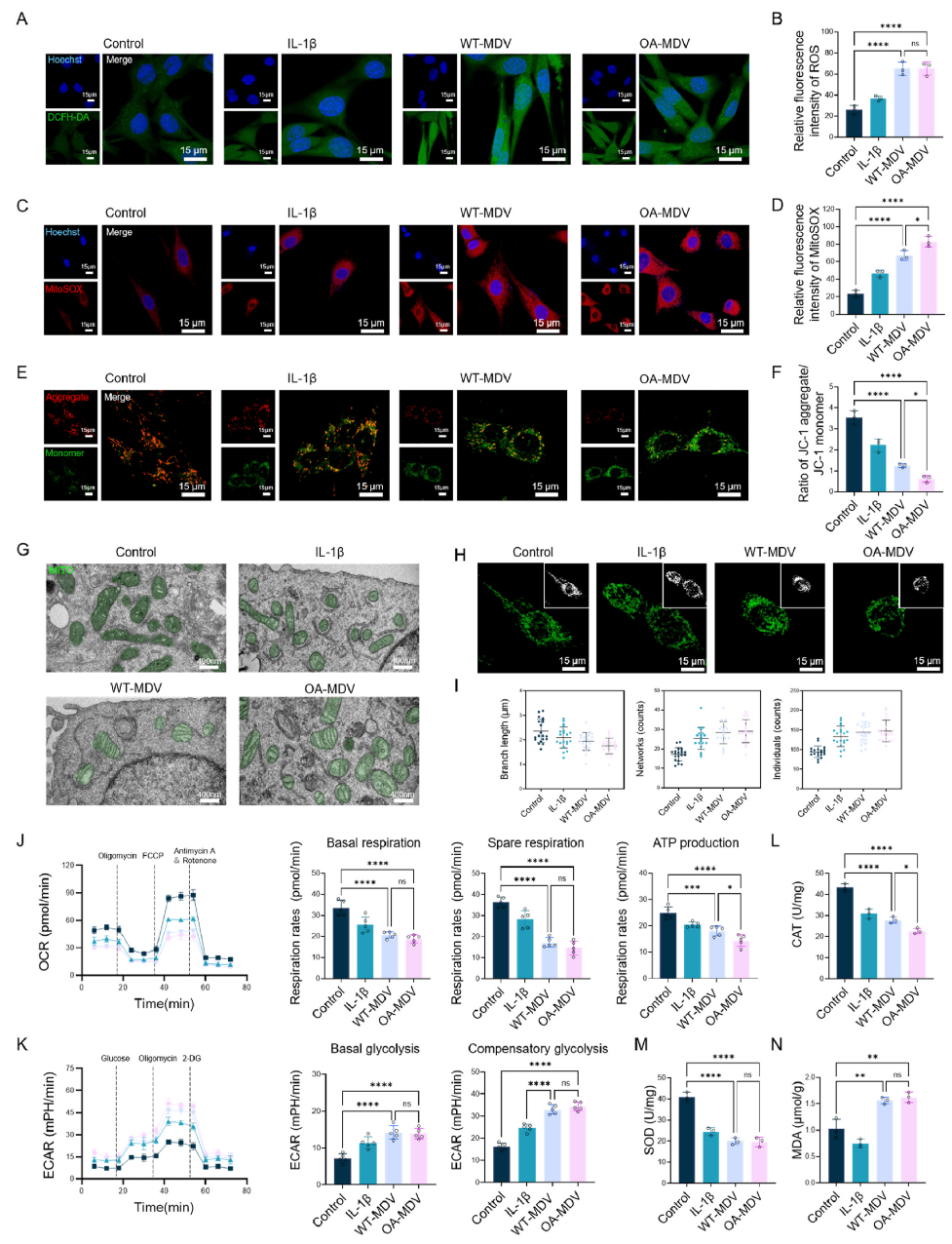
利用抗体芯片AAH-BLG-TOL(检测人类样本中181个 炎症及Toll/NOD-like 受体通路相关因子)对MDVs共培养的软骨细胞中微量功能表达细胞因子进行分析,发现OA-MDV组主要上调炎症通路相关蛋白,如STING、RIPK3、TANK、IRF3和TBK1;WT-MDV组则高表达RIPK3、TBK1、NFKB1、IL-1β等炎症相关蛋白。DEPs的KEGG分析发各组现在“胞质DNA感知通路”中均存在显著差异,结合ELISA、WB实验证明了MDVs处理可强烈激活STING通路,表现为磷酸化STING、TBK1和IRF3水平升高,MDVs可通过mtDNA激活cGAS–STING通路作用于软骨细胞,驱动炎症级联反应,促进OA进展。
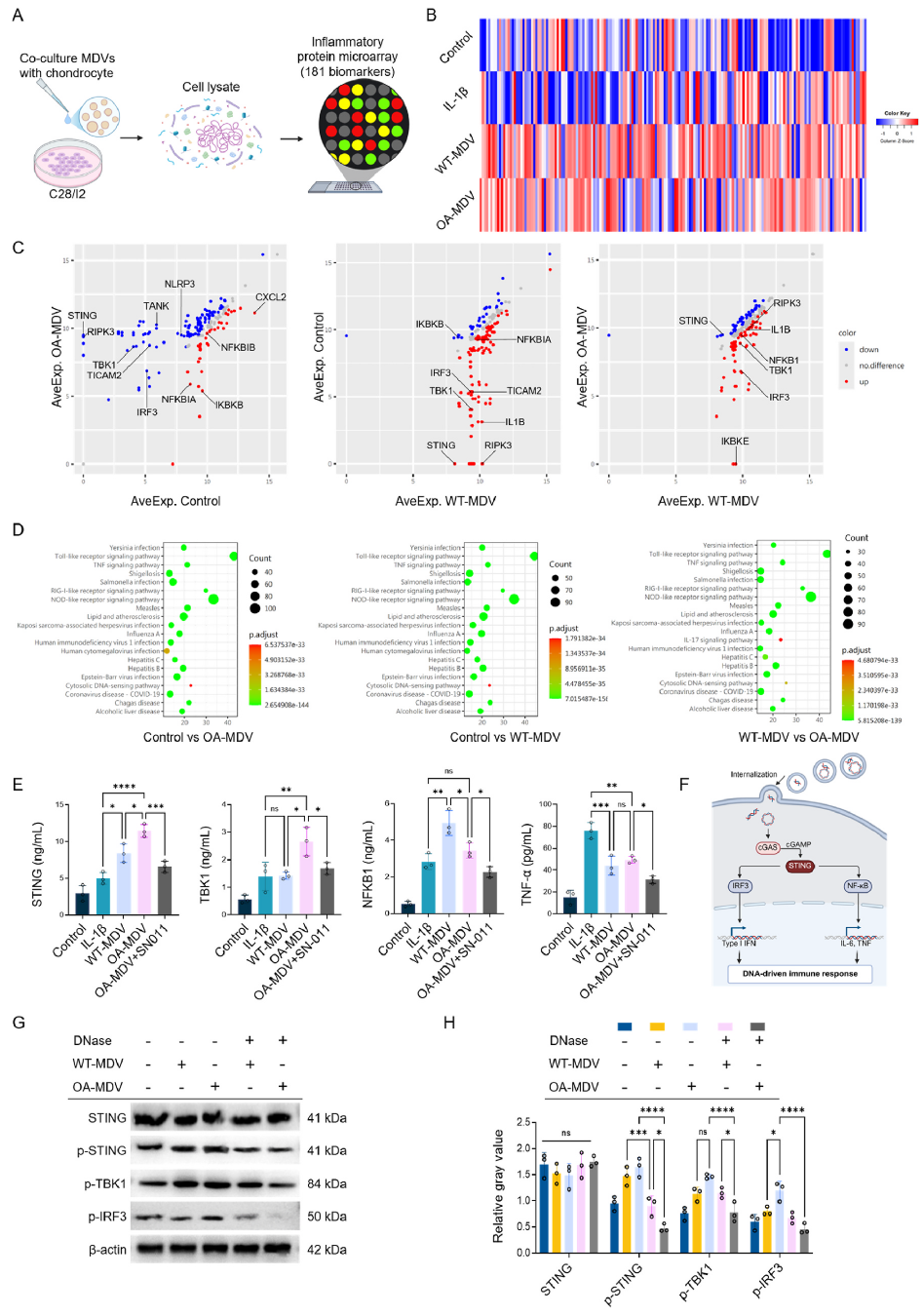
为了明确STING通路在OA病理生理中的作用,体内注射OA‑MDVs后影像学、显微CT、病理切片分析显示OA大鼠模型软骨退变、骨赘形成和滑膜炎显著加重;
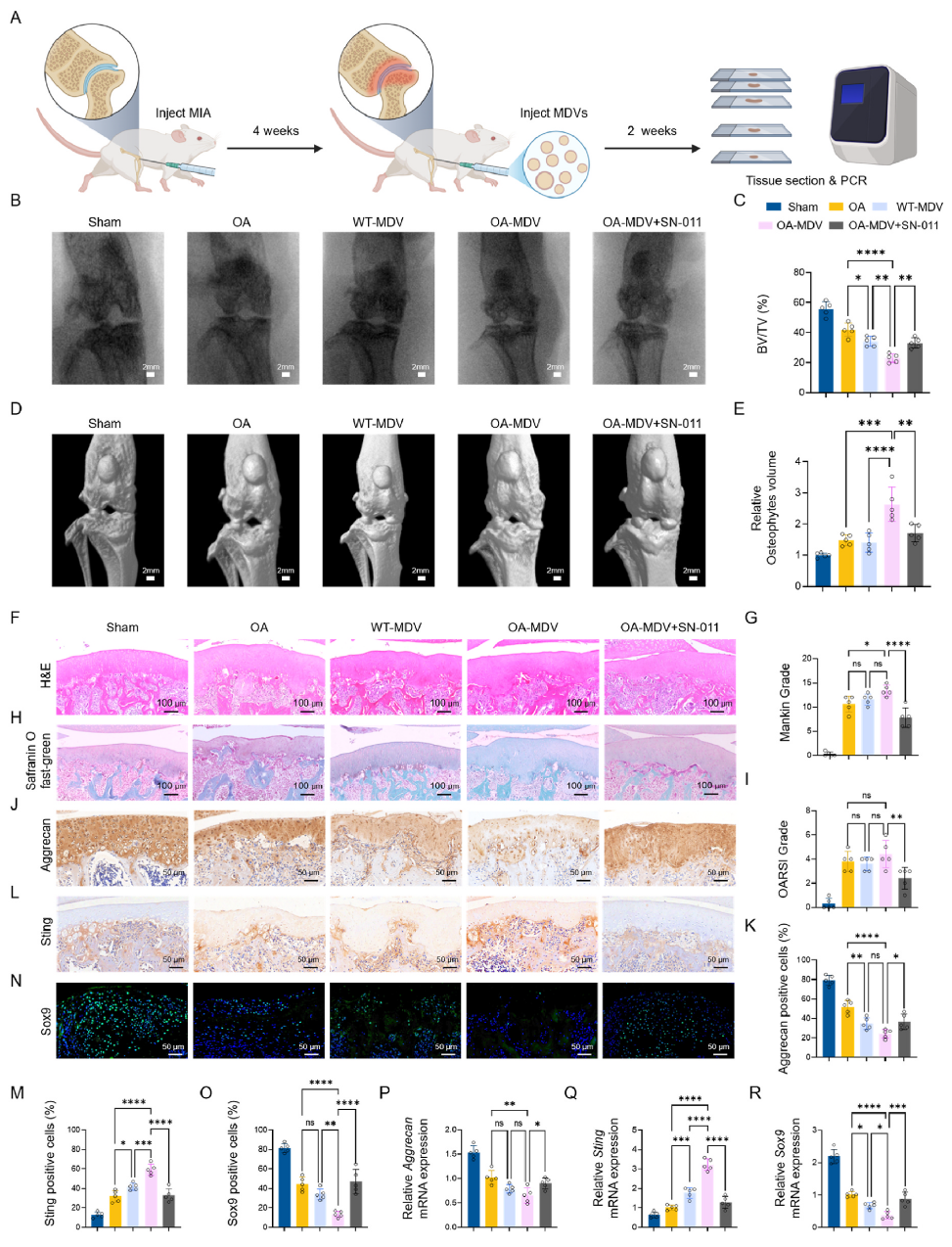
IF分析、WB及转录水平分析显示OA‑MDVs注射组中蛋白聚糖、Sox9等软骨合成标志物含量下降,炎症反应显著增强,SN‑011(STING抑制剂)可逆转MDVs引起的关节破坏和炎症反应。
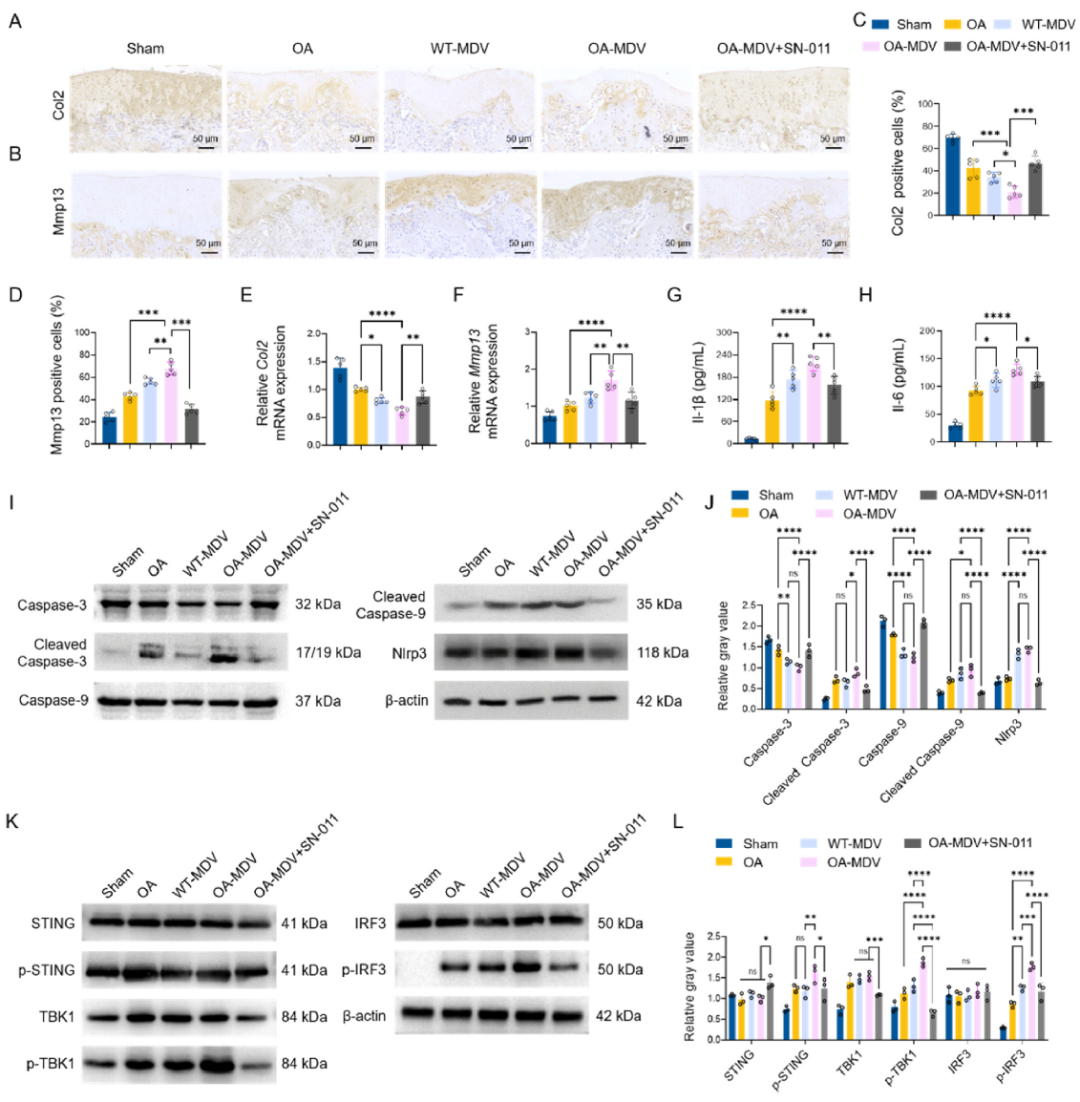
结合蛋白质芯片分析,这些数据共同表明,OA‑MDVs主要通过cGAS‑STING通路加剧细胞外基质降解、氧化应激和软骨细胞凋亡,而SN‑011可有效缓解这些病理过程。
研究结论
本研究首次揭示,在骨关节炎(OA)患者的滑液及髌下脂肪垫间充质干细胞(IPFP-MSCs)来源的细胞外囊泡(EVs)中,线粒体来源囊泡(MDVs)作为一种独特的EV亚群显著富集,并通过传递线粒体DNA(mtDNA)激活软骨细胞中的cGAS-STING信号通路,从而驱动OA的炎症进展与软骨退变。
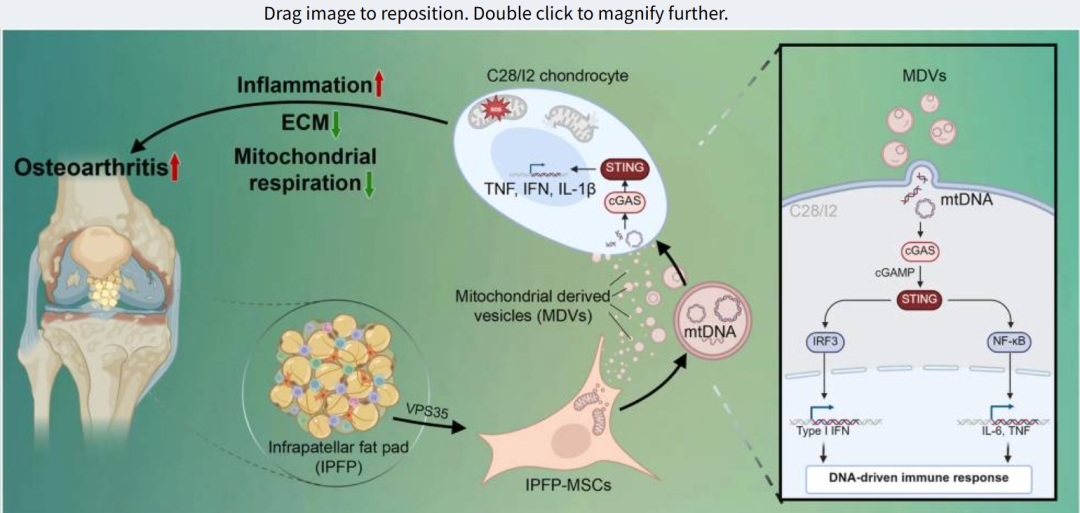
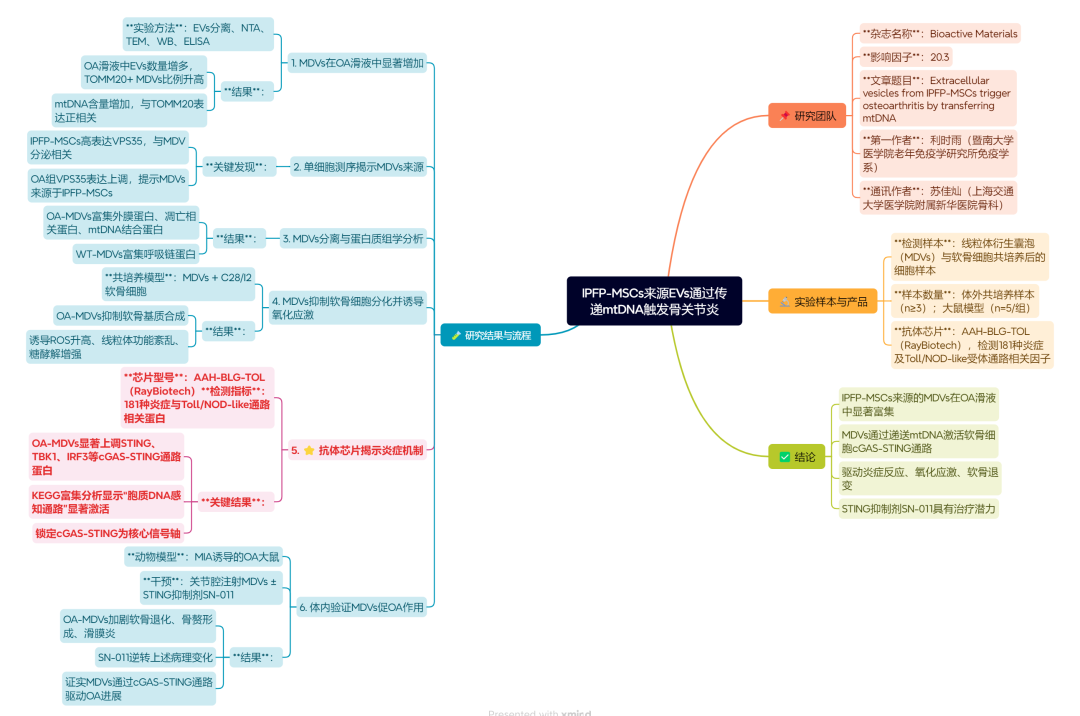
本研究通过囊泡分离与表征技术、多组学整合分析、细胞机制精细解析、以及体内外功能验证等多层次技术体系的有机结合,系统阐明了IPFP-MSCs来源的MDVs通过递送mtDNA激活cGAS-STING通路。
在机制探索阶段选用了能精准检测181种微量表达功能细胞因子的抗体芯片(RayBio, AAH-BLG-TOL)快速锁定cGAS-STING为核心通路,为后续连接MDVs与下游炎症信号通路提供关键及精准的线索。