瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
破解难治性哮喘机制!科罗拉多大学团队:过敏原破坏 DNA 抗炎作用,ILC2/TNFα 驱动中性粒细胞浸润
412 人阅读发布时间:2025-10-13 17:08
杂志名称: J Clin Invest
影响因子:13.6
文章题目: Allergens abrogate antiinflammatory DNA effects and unmask macrophage-driven neutrophilic asthma via ILC2/STING/TNF-α signaling
过敏原通过ILC2/STING/TNF-α信号消除抗炎DNA作用,揭露巨噬细胞驱动的嗜中性粒细胞哮喘
第一作者:Anand Sripada
通讯作者: Rafeul Alam
作者单位:过敏与免疫学部,美国科罗拉多大学医学院医学系
本研究所实验中所使用的产品:AAH-CYT-5(检测人类样本中80种微量表达细胞因子

本实验检测样本:肺泡灌洗液(BALF)
研究背景
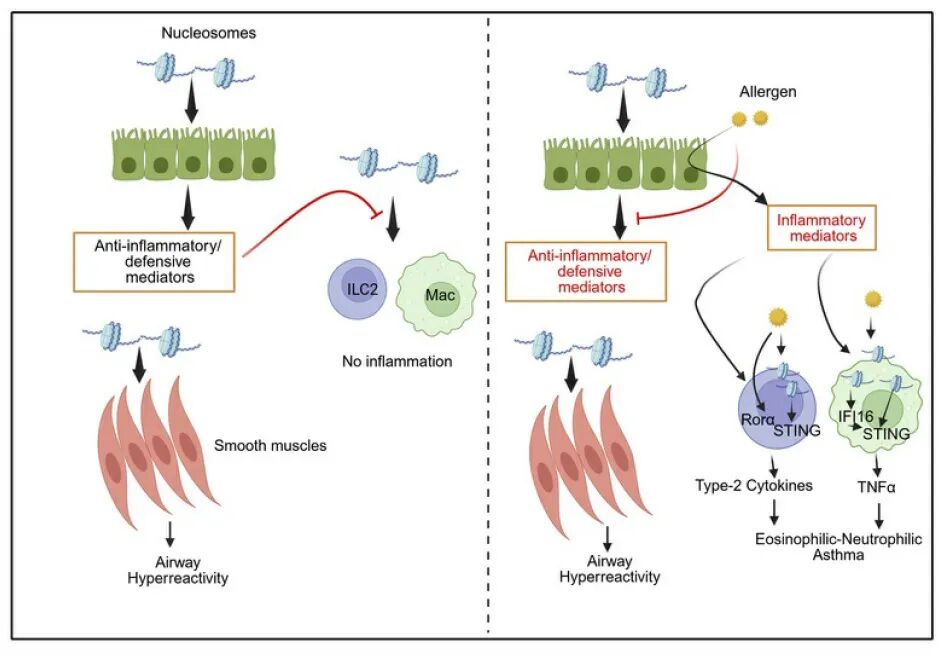
中性粒细胞性和混合性中性粒细胞-嗜酸性粒细胞性哮喘的发病机制尚不明确。以往研究报道哮喘患者痰液中细胞外DNA升高,并与中性粒细胞数量相关,但其具体作用机制不清。本研究旨在探讨细胞外DNA及其形成的核小体在哮喘中的作用,特别是其在过敏原暴露下如何从抗炎转变为促炎状态,并揭示其通过STING-TNFα信号通路驱动中性粒细胞炎症的机制。
研究结果
1、哮喘患者体液中DNA与核小体升高
在中性粒细胞性哮喘患者的BAL、血清和痰液中,DNA和核小体水平显著升高,且与中性粒细胞数量正相关。
MPO结合的DNA(提示中性粒细胞来源)在BAL中显著增加。
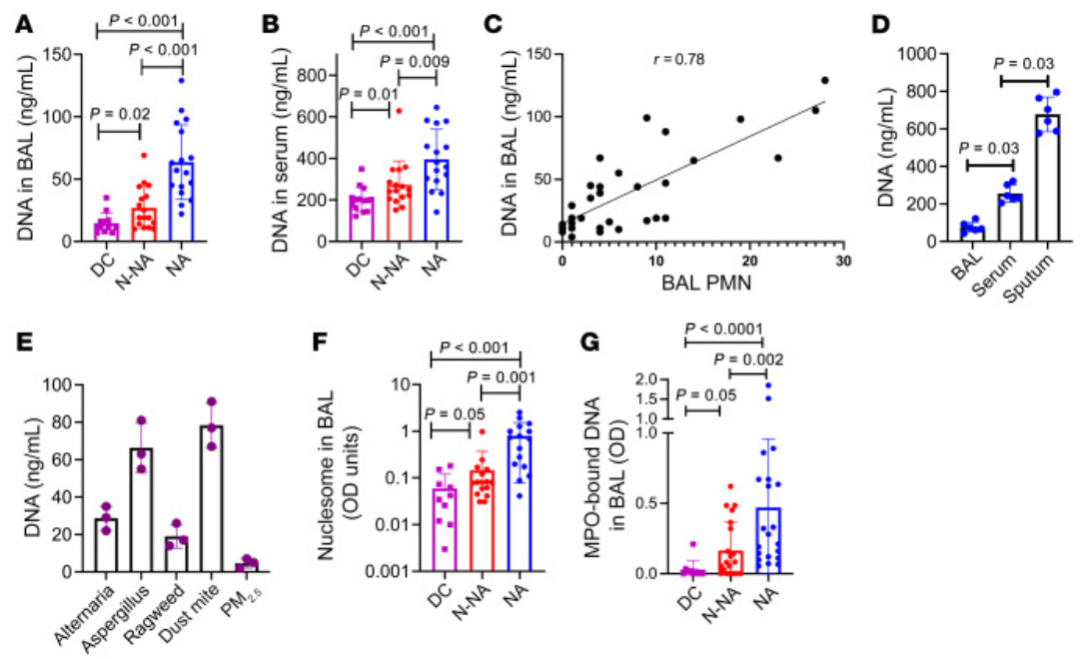
2、DNA传感器及其相关细胞因子在气道组织中上调
中性粒细胞性哮喘患者的气道组织中,DNA传感器(如IFI16、cGAS)表达升高,且IFI16发生胞质转位,STING磷酸化增强。

3、DNA/核小体本身无炎症性,但其促炎潜力在过敏原存在下被“解锁”
单独给予小鼠DNA或核小体未引起气道高反应性或炎症。当与Alternaria等过敏原共暴露时,DNA/核小体诱导混合性中性粒细胞-嗜酸性粒、AHR和黏液分泌。

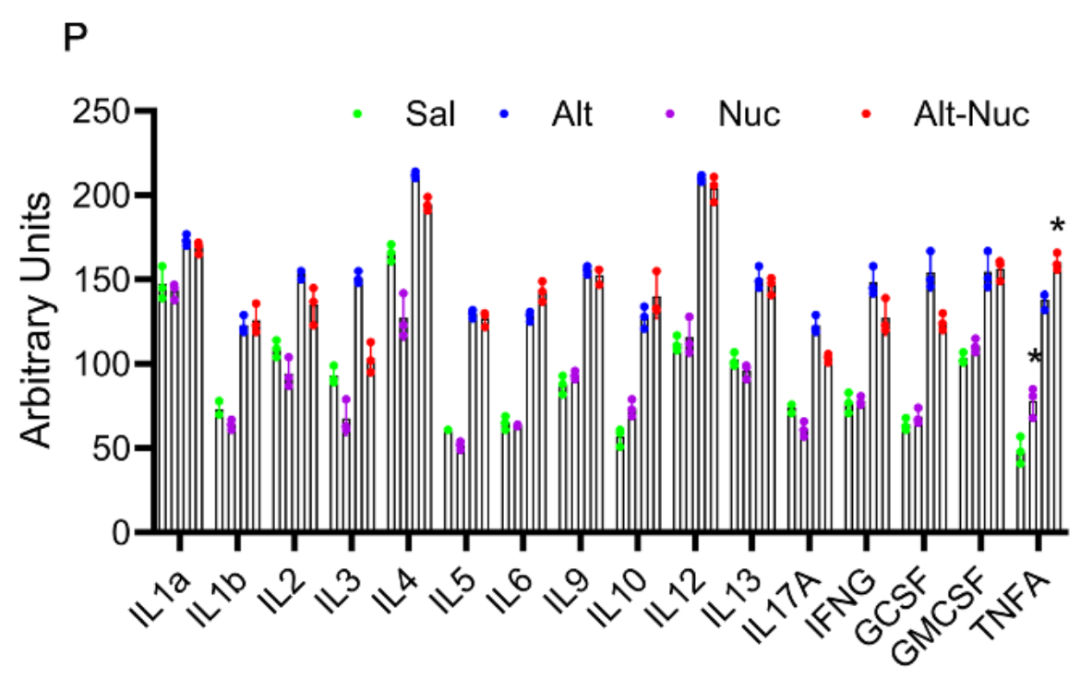
利用抗体芯片对小鼠模型中的细胞因子和趋化因子检测后发现 Nuc 能抑制 Alt 引起的第 1 型(CCL5、IFN-γ)、第 2 型(CCL11 和 IL-4)以及其作用表现为第 3 型(IL-17A)反应的增强,同时又放大了先天性(IL-1β、IL-6 和 TNF-a)反应。。


4、核小体诱导抗炎/防御基因,而Alt抑制其表达并促进促炎反应
RNA-seq显示,核小体单独处理上调抗菌、抗炎和纤毛相关基因(如BPIFA1、GDF15)。
Alt抑制这些基因表达,并促进巨噬细胞和ILC2活化,增强TNFα等促炎因子产生。

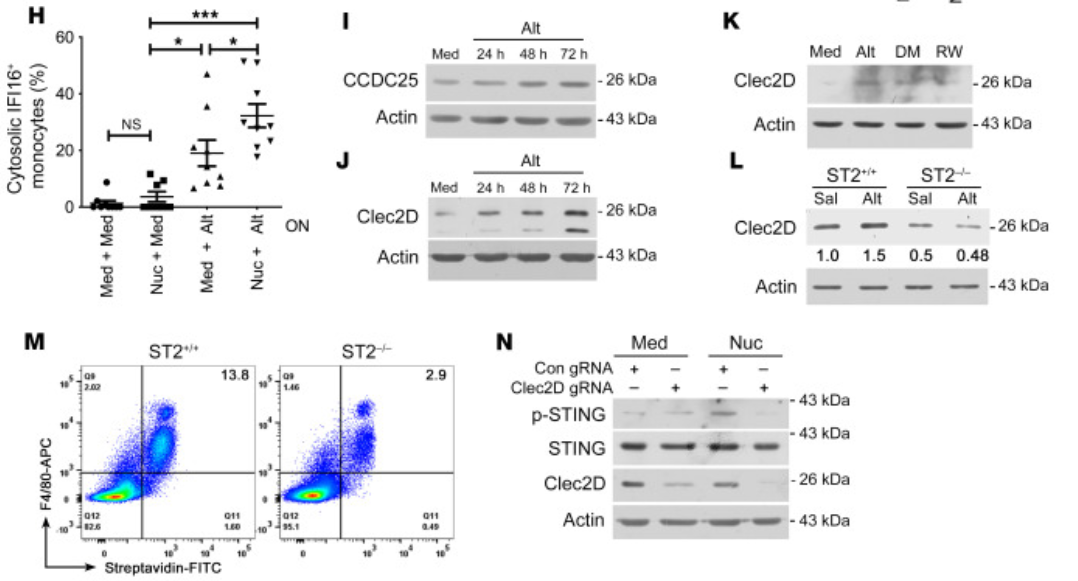
5、Alt促进DNA/核小体摄取与STING活化
Alt上调受体CCDC25和CLEC2D,促进核小体内化,激活STING-TBK1通路。
CLEC2D缺失显著抑制STING磷酸化与炎症反应。
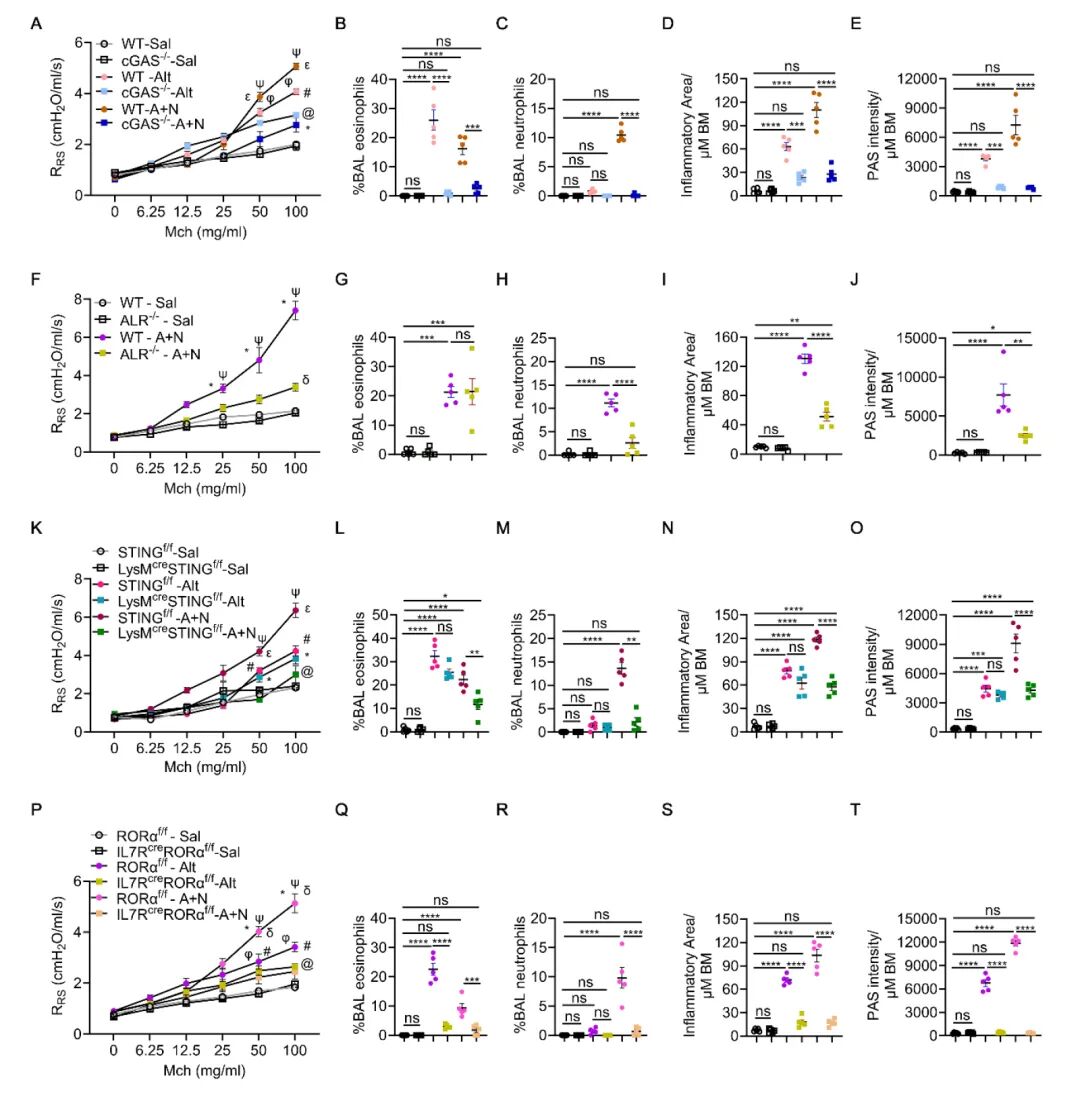
6、STING、cGAS、ALR、ILC2和TNFR2是表型关键分子
基因敲除(Sting、Cgas、ALR、IL7RCre:Rorα、Tnfr2)或细胞特异性敲除(LysM Cre:Sting)均显著抑制Alt-Nuc诱导的哮喘表型。
7、ILC2是TNFα的主要来源,驱动ICAM1表达与中性粒细胞浸润
在Alt-Nuc模型中,78%的ILC2高表达TNFα,贡献了BAL中36%的TNFα总量。
ILC2缺失导致ICAM1表达几乎完全丧失,中性粒细胞浸润显著减少。

本研究首次系统揭示了过敏原通过破坏DNA/核小体的抗炎作用,解锁其促中性粒细胞炎症潜力的全新机制。
-
过敏原通过上调CLEC2D等受体促进核小体内化;
-
激活STING-TBK1通路,诱导ILC2高表达TNFα;
-
通过TNFα-TNFR2-ICAM1轴驱动中性粒细胞浸润;
-
最终导致混合性中性粒细胞-嗜酸性粒细胞性哮喘的发生。
这一发现不仅深化了对难治性哮喘发病机制的理解,也为开发靶向STING-TNFα通路的治疗策略提供了理论依据。
研究亮点
本研究使用RayBiotech抗体芯片对小鼠BALF和人类巨噬细胞培养上清中的多种细胞因子/趋化因子进行了半定量分析。
芯片结果明确显示:
-
Nuc单独处理诱导CCL1、CCL9、TNFα,但抑制IL4、CCL5等Th2/Th1型细胞因子;
-
Alt-Nuc联合处理进一步放大TNFα、IL-1β、IL6等先天免疫细胞因子,同时抑制Th2/Th17反应;
-
STING缺失导致多种细胞因子(包括TNFα、IL6、CXCL9等)显著下降。
芯片数据为揭示Nuc与Alt协同作用下的免疫极化转变(从抗炎到促炎)提供了全局性、高通量的分子证据,是机制阐释的关键实验支撑。