瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
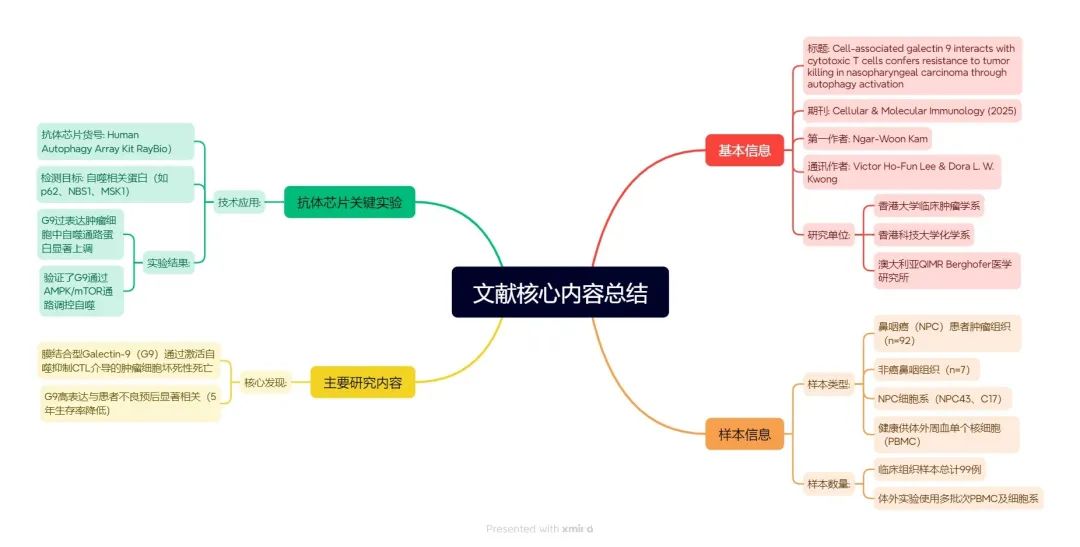
IF21.8| 多组学技术联合突破——鼻咽癌T淋巴细胞功能抑制的深层机制被揭示,或可成为免疫治疗新靶点
170 人阅读发布时间:2025-05-06 09:57
杂志名称:Cellular & Molecular Immunology
影响因子:21.8
文章题目:Cell-associated galectin 9 interacts with cytotoxic T cells confers resistance to tumor killing in nasopharyngeal carcinoma through autophagy activation
通讯作者:Victor Ho-Fun Lee, Dora L. W. Kwong
单位:香港大学临床肿瘤学中心、香港科技大学化学系等
本实验所用产品:AAH-ATG-1(半定量检测人类样本中自噬相关20个细胞因子)
实验样品类型:细胞上清
研究背景
鼻咽癌(NPC)是一种与EB病毒(EBV)感染高度相关的恶性肿瘤,尽管细胞毒性T淋巴细胞(CTL)在肿瘤微环境(TME)中浸润,但其杀伤功能常被抑制。研究表明,免疫检查点分子如PD-1/PD-L1在NPC中疗效有限,提示存在其他免疫逃逸机制。

关键问题:
1) 肿瘤细胞如何通过表面分子(如Galectin 9, G9)与CTL相互作用,抵抗杀伤?
2) 自噬激活是否在G9介导的免疫逃逸中起关键作用?
文章结果
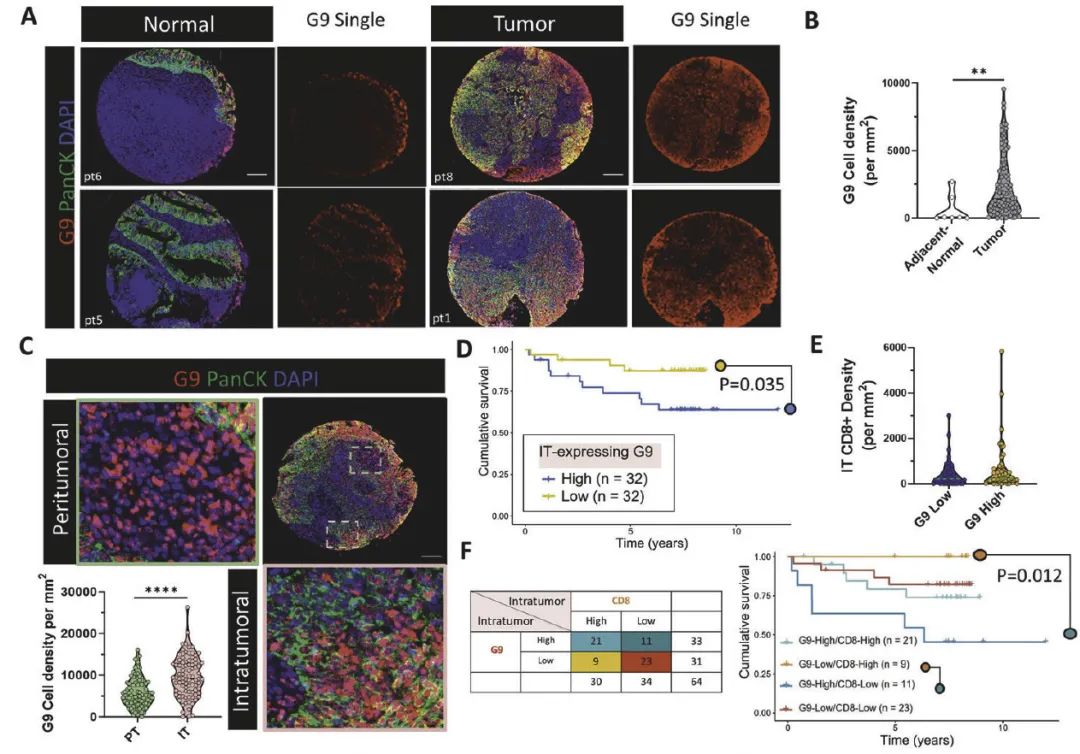
1. G9在NPC中的表达与临床预后相关
组织分析:通过多重免疫组化(mIHC)发现,G9在NPC肿瘤细胞膜上高表达(80%病例),且与患者较差的总生存率相关(5年生存率:G9-high 68.75% vs. G9-low 81.25%)。
空间分布:CD8+ T细胞倾向于聚集在G9-high肿瘤细胞周围(<15 μm),但杀伤功能受限(图1D-F)。
。
2. G9抑制CTL的细胞毒功能
功能缺陷:G9-high肿瘤细胞中,CTL的颗粒酶B(GzB)释放减少,且GzB在靶细胞内的活性降低。
机制:G9通过诱导自噬(LC3-II/Beclin1上调)抑制坏死性死亡(RIPK1/MLKL下调),而非凋亡(图4H-J)。
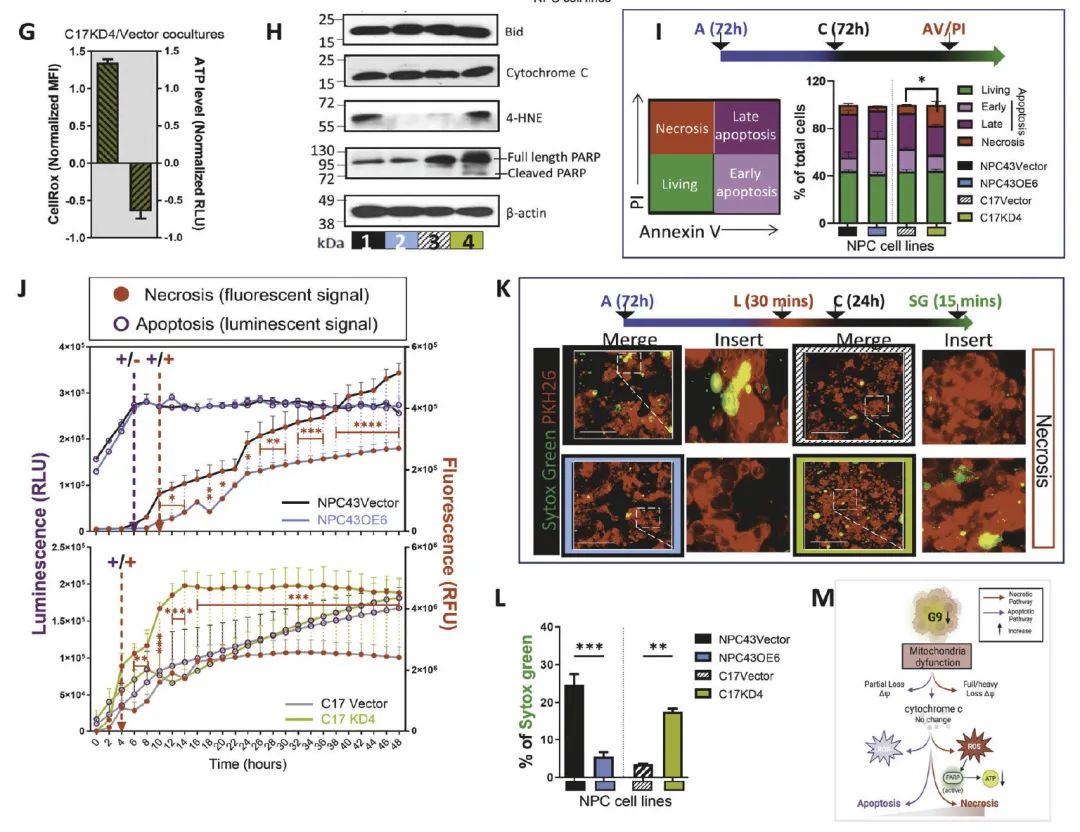
4. 自噬-坏死平衡调控肿瘤抵抗
蛋白质组学:利用人类自噬多因子检测抗体芯片(RayBio AAH-ATG-1),对G9-high肿瘤细胞分泌蛋白进行检测,发现相关通路(如AMPK/mTOR)显著激活,而坏死相关蛋白(RIPK1/RIPK3)下调(图5)。
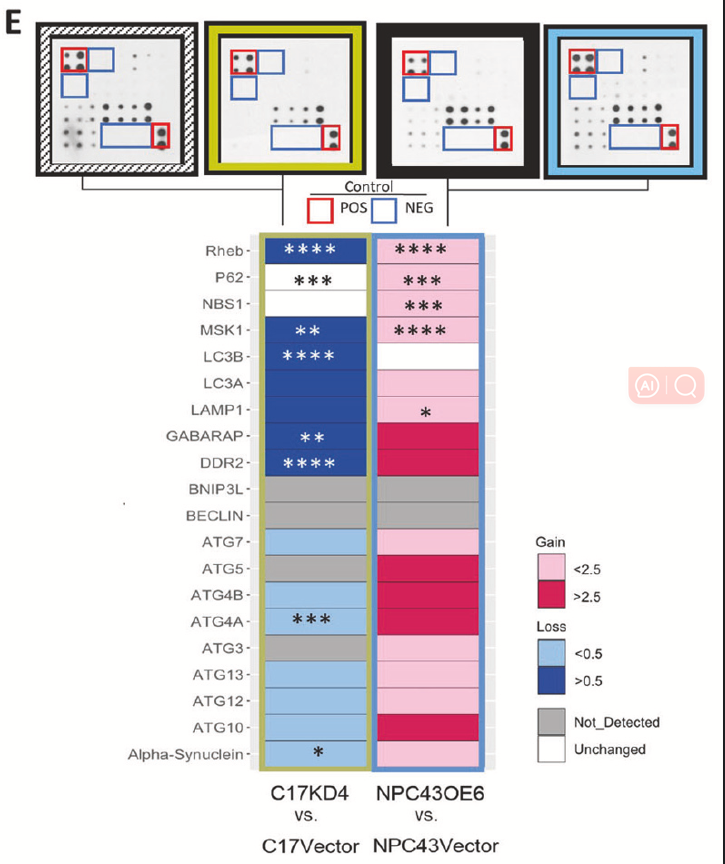
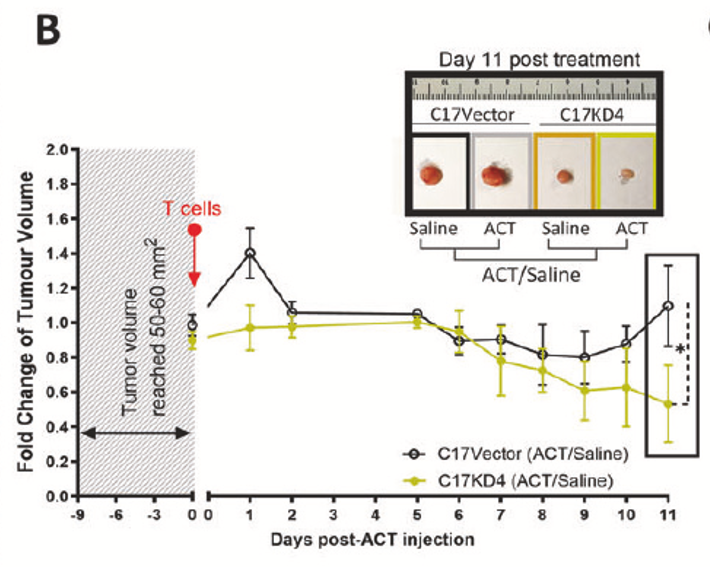
5. 体内验证与治疗潜力
小鼠模型:G9敲低联合EBV特异性T细胞(EBVSTs)治疗显著抑制肿瘤生长(图7B)。自噬抑制剂联合PD-L1抗体(Durvalumab)进一步改善疗效(图7H)。
临床相关性:NPC患者组织中,G9-high区域自噬标志物(Beclin1)升高,坏死标志物(RIPK1)降低。
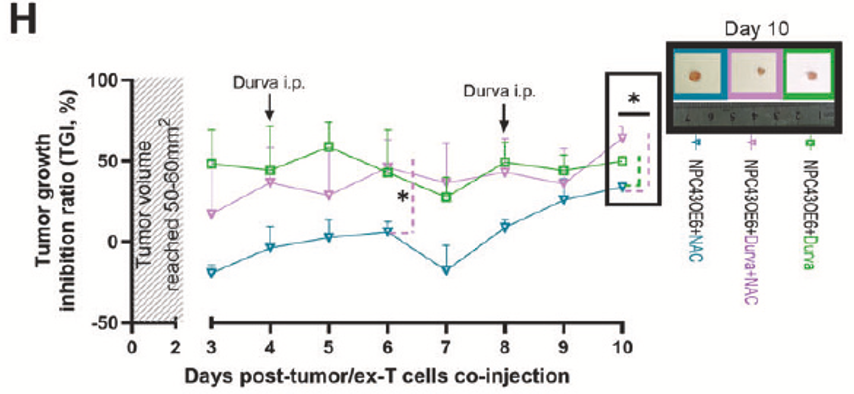
结论
研究首次揭示膜结合G9通过自噬激活抑制CTL介导的坏死性死亡,而非凋亡,靶向G9或自噬通路(如AMPK抑制剂)可增强免疫疗法疗效,并且冻干保存的G9调控策略或适用于NPC的个性化治疗。
在本研究中利用了自噬核心细胞因子检测抗体芯片作为关键蛋白筛选工具,为揭示“G9-自噬-坏死抵抗”轴提供了关键实验证据。其高通量特性加速了分子机制的解析,并指导了后续药物靶点的选择,最终支撑了“靶向自噬可增强免疫治疗效果”的结论。