瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
IF11| RayBio精准蛋白质组学助力儿童早衰症治疗关键调控蛋白
92 人阅读发布时间:2025-03-17 15:40
杂志名称:Aging Cell
影响因子:11.005
文章题目:Angiopoietin-2 reverses endothelial cell dysfunction in progeria vasculature
作者单位:马里兰大学细胞生物学和分子遗传学系
研究团队:Sahar Vakili团队
本实验所用产品:AAH-CYT-1000-2(同时检测120个人类样本中微量表达功能性细胞因子)
检测样本:细胞上清
Hutchinson-Gilford Progeria Syndrome (何奇森-吉尔福德儿童早衰症,HGPS)是一种罕见的遗传性早老症,其特征是患者在儿童期就表现出类似老年的症状,包括心血管疾病。
HGPS是由LMNA基因突变导致的,这种突变产生了一种异常的蛋白质——Progerin,该蛋白质会干扰细胞核的正常结构与功能,尤其是内皮细胞的功能障碍被认为是导致HGPS患者心血管疾病的关键因素之一。
本研究旨在探究HGPS内皮细胞中Angiopoietin-2(Ang2)的作用及其对血管功能的影响。其核心发现如下:
-
与健康内皮细胞相比,HGPS患者来源的内皮细胞中Ang2的mRNA和蛋白水平显著降低。
-
外源性Ang2的添加能够促进HGPS内皮细胞的血管生成、迁移,并恢复正常的基因表达。
-
Ang2治疗能够通过激活内皮型一氧化氮合酶(eNOS)来恢复一氧化氮的产生和释放。
-
Ang2处理能够改善HGPS内皮细胞通过旁分泌对血管平滑肌细胞的不利影响,减少细胞死亡和衰老。
-
Ang2通过与Tie2受体结合,激活Akt信号通路,发挥其对内皮细胞的保护作用。
研究思路
Progerin在内皮细胞中的积累会导致细胞衰老、炎症反应增强以及血管功能障碍,而这些正是HGPS患者心血管疾病的主要诱因。
动物模型研究也显示,限制Progerin表达至内皮细胞的小鼠模型中出现了系统性的血管功能障碍,伴有心脏肥大、血管周围和间质纤维化以及早逝现象,进一步支持了内皮细胞功能障碍在HGPS病理过程中的重要作用。
此外,内皮细胞在形成血管的过程中扮演着至关重要的角色。这一过程需要高度的协调,同时很大程度上依赖于细胞之间的信号交流。血管的分化和成熟受到外部因素的调控,包括细胞间通信、生长因子梯度等。
基于此背景,作者提出假设:内皮细胞中Progerin的表达干扰了细胞间的正常通讯,导致血管功能障碍。
为了验证这一假设,作者首先较健康人与HGPS患者来源的诱导多能干细胞(iPSC)分化而成的内皮细胞分泌组。通过采用可以同时检测120种指标的蛋白芯片,研究人员发现Angiopoietin-2 (Ang2) 在HGPS内皮细胞中的表达显著下降。这一观察激发了进一步探索Ang2是否能作为潜在治疗手段的想法。接下来,作者设计了一系列实验来逐步验证这一假设:
条件培养基实验:通过将HGPS内皮细胞暴露于健康内皮细胞的条件培养基中,观察到HGPS内皮细胞中与衰老相关的基因表达得到了部分逆转,提示健康内皮细胞分泌的某些因子可能具有保护作用。
Ang2处理实验:直接用不同浓度的Ang2处理HGPS内皮细胞,评估其对细胞增殖、迁移和血管生成能力的影响。结果显示,Ang2能够有效改善HGPS内皮细胞的这些功能缺陷。
基因表达分析:通过定量RT-PCR检测Ang2处理前后HGPS内皮细胞中关键基因的表达变化,发现Ang2能够上调eNOS和PECAM1等有益基因的表达,同时下调p16等与细胞衰老相关的基因表达。
分子机制探究:进一步研究Ang2的作用机制,发现Ang2通过激活Tie2受体和下游的Akt信号通路,促进了内皮细胞的存活和功能恢复。
研究结果
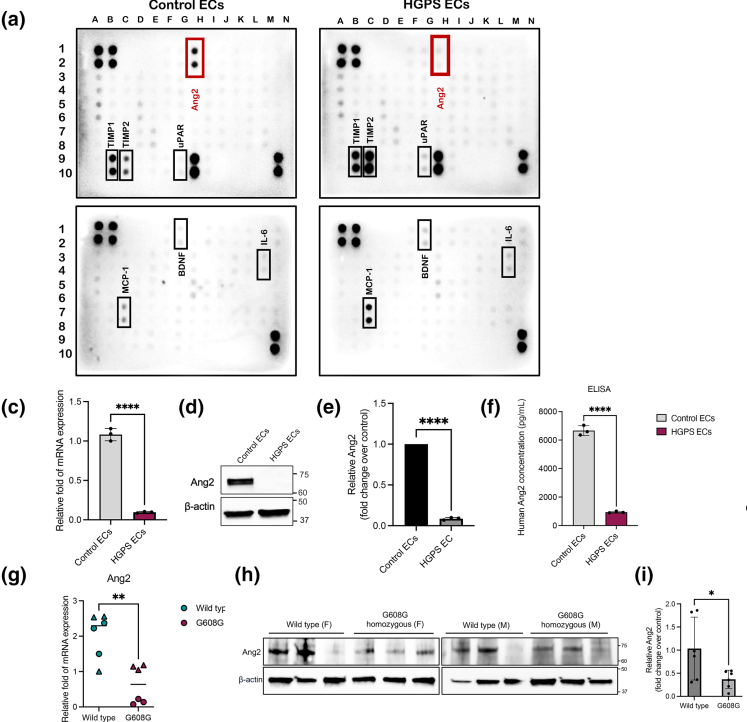
1. 蛋白芯片筛选发现肥胖Ang2在HGPS动物模型主动脉中的表达差异
通过采用能同时检测120种包括趋化因子,生长因子和细胞因子的蛋白芯片对健康和HGPS患者EC分泌物进行检测,研究人员发现HGPS内皮细胞中多种与血管生成和内皮细胞功能相关的生长因子和细胞因子的表达均显著下调,其中Ang2的下调尤为明显。通过定量RT-PCR和Western blotting分析,研究者检测到HGPS内皮细胞中Ang2的mRNA和蛋白水平分别比健康对照组降低了13倍和显著减少。此外,通过ELISA检测条件培养基中的Ang2分泌量,结果显示HGPS内皮细胞的Ang2分泌量仅为健康对照组的六分之一。
2. Ang2改善HGPS ECs迁移并激活与新生血管化和存活相关的基因
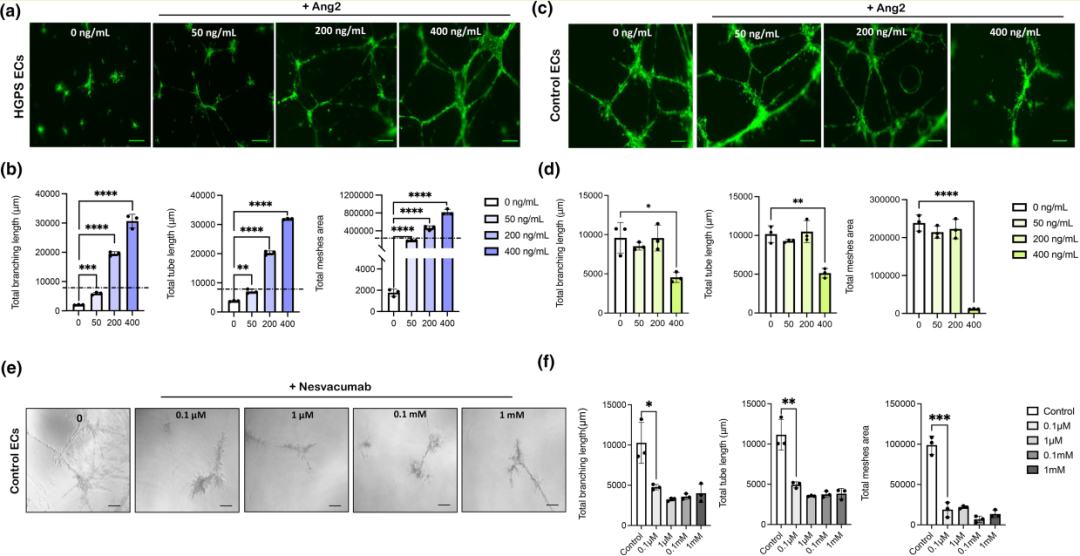
为了评估Ang2对HGPS内皮细胞血管生成能力的影响,研究者设计了一个管状形成实验。具体来说,研究者在Matrigel基质上培养了HGPS内皮细胞,并分别添加了不同浓度的Ang2(0 ng/mL、50 ng/mL、200 ng/mL 和 400 ng/mL),以观察细胞的血管生成能力。实验结果显示,随着Ang2浓度的增加,HGPS内皮细胞形成的微血管网络长度、分支长度和网孔面积均显著增加。特别是在400 ng/mL的Ang2处理下,HGPS内皮细胞形成的微血管网络最为发达,细胞覆盖的区域最广,网孔面积最大,分支长度也最长。这些结果表明,外源性Ang2能够剂量依赖性地恢复HGPS内皮细胞的血管生成能力,且在较高浓度下效果尤为显著。
3. Ang2促进细胞迁移,修复伤口
为了评估Ang2对HGPS内皮细胞迁移能力的影响,研究者设计并进行了一项划痕实验。具体来说,研究者在六孔板中培养了HGPS内皮细胞,当细胞达到完全汇合时,在细胞单层上制造了一条均匀的人工伤口。随后,分别向伤口处添加了含有不同浓度Ang2的培养基,包括0 ng/mL(对照组)和50 ng/mL的Ang2处理组。实验过程中,每隔6小时拍摄一次伤口愈合的显微镜图像,以记录伤口闭合的情况。

实验结果显示,与未处理的对照组相比,添加50 ng/mL Ang2的处理组中,HGPS内皮细胞的迁移速度显著加快。在18小时的时间点,对照组的伤口仍然有明显的未愈合区域,而50 ng/mL Ang2处理组的伤口几乎完全闭合,伤口面积显著减少,接近正常内皮细胞的迁移水平。这些结果表明,外源性Ang2能够显著促进HGPS内皮细胞的迁移能力,加速伤口愈合过程。
4. Ang2处理部分恢复HGPS内皮细胞中关键基因的表达
为了深入理解Ang2对HGPS内皮细胞功能的改善机制,研究者进行了定量RT-PCR分析,检测了Ang2处理前后HGPS内皮细胞中多个关键基因的表达变化。这些基因包括与血管生成和内皮细胞功能密切相关的MMP2、eNOS、PECAM1、TIMP1、MMP9和TIMP2。
实验结果显示,与未处理的对照组相比,经过50 ng/mL Ang2处理的HGPS内皮细胞中,MMP2、eNOS和PECAM1的表达水平显著上调。MMP2是一种基质金属蛋白酶,参与细胞外基质的降解和重塑,对血管生成至关重要;eNOS(内皮型一氧化氮合酶)负责生成一氧化氮,对维持血管舒张和血流具有重要作用;PECAM1(血小板内皮细胞黏附分子1)则在内皮细胞间的相互作用和血管稳定性中起关键作用。这些基因表达的恢复表明,Ang2能够部分恢复HGPS内皮细胞的正常功能。
此外,TIMP1(组织金属蛋白酶抑制剂1)的表达在Ang2处理后也有所下降。TIMP1通常与MMPs相互作用,抑制其活性,因此TIMP1的减少有助于平衡MMPs的活性,进一步促进血管生成。然而,MMP9和TIMP2的表达在Ang2处理后没有显著变化,这表明Ang2对HGPS内皮细胞的改善作用可能主要通过调节MMP2、eNOS和PECAM1等基因实现。
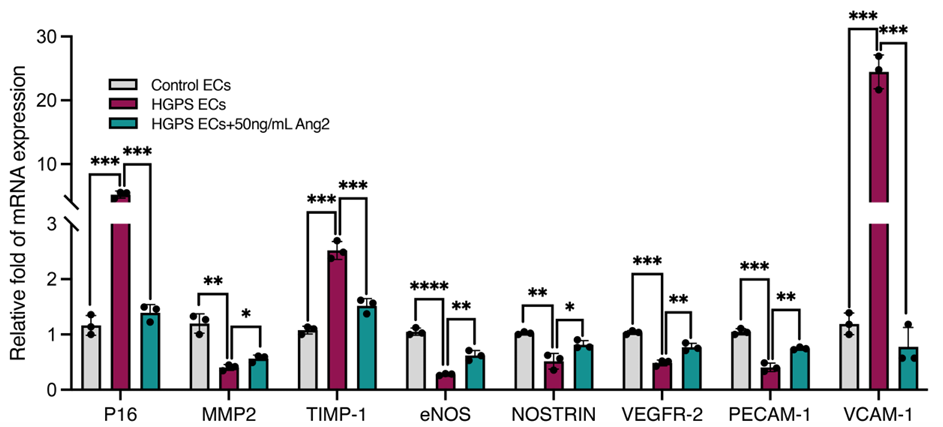
5. Ang2通过改善其旁分泌效应,对HGPS血管平滑肌细胞产生积极影响
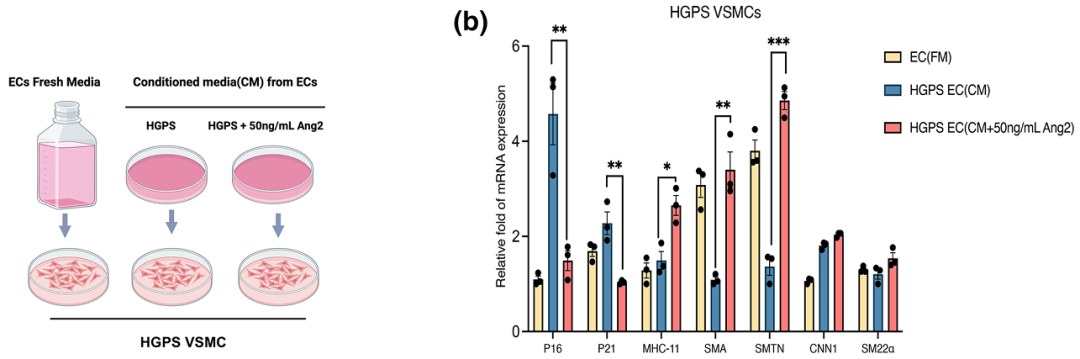
研究者通过条件培养基实验,将HGPS血管平滑肌细胞(VSMCs)分别暴露于新鲜内皮细胞生长培养基(FM)、HGPS内皮细胞条件培养基(CM)和经50 ng/mL Ang2处理的HGPS内皮细胞条件培养基(CM+Ang2)中,观察VSMCs的变化。结果显示,Ang2处理的HGPS内皮细胞条件培养基能够显著降低p16和p21的表达,同时增加SMA、SMT和smMHC等平滑肌细胞特异性标志物的表达。
6. 对Ang2起作用的机制研究
为了深入理解Ang2对HGPS内皮细胞功能的改善机制,研究者进一步探讨了Ang2的具体作用途径。实验结果显示,Ang2通过激活Tie2受体及其下游的Akt信号通路,促进了内皮细胞的存活和功能恢复。Tie2受体是一种重要的酪氨酸激酶受体,主要在内皮细胞中表达,其激活能够触发多种信号传导途径,包括Akt信号通路。Akt信号通路的激活能够促进细胞存活、增殖和代谢,同时抑制细胞凋亡和衰老。
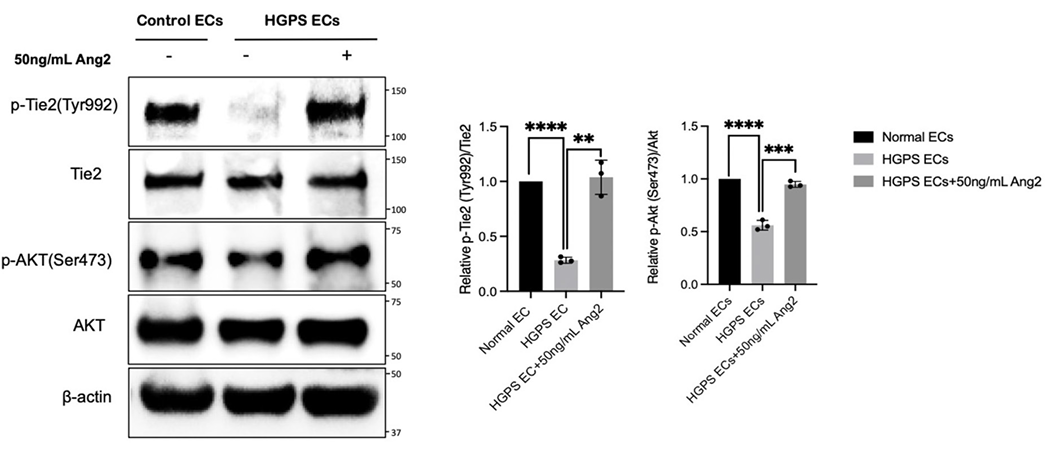
此外,研究还发现,Ang2能够显著刺激一氧化氮(NO)的产生和释放,特别是在内皮细胞功能受损的情况下。一氧化氮是一种重要的血管舒张因子,对维持血管内皮功能和血流具有重要作用。这些结果表明,Ang2通过激活Tie2-Akt信号通路和促进NO的生成,多方面地改善了HGPS内皮细胞的功能障碍,为其在HGPS相关心血管疾病的治疗中提供了潜在的机制支持。

1

结论及展望
本文揭示了Angiopoietin-2 (Ang2) 在恢复Hutchinson-Gilford Progeria Syndrome (HGPS) 内皮细胞功能障碍中的重要作用。研究发现,Ang2能够显著改善HGPS内皮细胞的血管生成和迁移能力,部分恢复相关基因表达,并通过旁分泌效应改善血管平滑肌细胞的功能。具体机制表明,Ang2通过激活Tie2受体和下游的Akt信号通路,促进内皮细胞的存活和功能恢复,同时刺激一氧化氮(NO)的产生和释放。尽管取得了重要进展,但研究仍存在不足,如具体旁分泌因子未明确、缺乏长期动物模型研究和临床试验数据等。未来的研究需要进一步优化剂量、评估长期效果和安全性,并探索与其他治疗方法的联合应用。