瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
IF17.06| RayBio精准蛋白质组学帮助快速破译皮肤影响骨组织衰老中的关键因子
127 人阅读发布时间:2025-03-17 15:37
杂志名称:Nat Aging
影响因子:17.06
文章题目:Skin chronological aging drives age-related bone loss via secretion of cystatin-A
作者单位:南方医科大学附属第三医院
通讯作者:黄彬
本实验所用产品:QAH-CAA-640(同时检测640个人类样本中微量表达功能性细胞因子)
检测样本:血清、细胞上清
骨质疏松和皮肤衰老,这两个看似不相关的健康问题,实际上可能有着紧密的联系。许多人担心随着年龄的增长,骨骼会变脆弱,皮肤会失去弹性和活力。但你有没有想过,为什么年纪大了,骨头和皮肤都会出现问题呢?
相关科学研究揭示了一个惊人的事实:皮肤衰老可能直接影响我们的骨骼健康。研究者们发现,皮肤中的一种名为Csta的蛋白质,它在年轻皮肤中的分泌量较高,但随着年龄的增长,这种蛋白质的分泌会减少。有趣的是,Csta不仅对皮肤健康至关重要,它还能影响骨骼的新陈代谢,帮助维持骨密度。
该研究成果于2022年发表在nature aging杂志上,题为“Skin chronological aging drives age-related bone loss via secretion of cystatin-A”,研究团队为南方医科大学附属第三医院黄彬教授团队。
精华版
本研究探讨了皮肤衰老与骨质疏松之间的因果关系,特别关注了皮肤分泌的Csta蛋白。
-
研究发现,随着皮肤老化,Csta分泌减少,这与小鼠和人类骨质流失相关。
-
通过使用Csta条件敲除小鼠模型和AAV2-Cre载体,研究者发现Csta的缺失导致表皮变薄和骨量减少。
-
体外实验中,Csta促进了前成骨细胞和前破骨细胞的增殖,但抑制了破骨细胞的分化。
-
此外,Csta与Rack1蛋白相互作用,影响骨细胞的增殖和分化。
-
研究还发现,局部应用calcipotriol能增加表皮中Csta的表达,从而缓解骨质疏松症状。
这些结果揭示了皮肤通过Csta对骨代谢的内分泌调节作用,并为治疗老年骨质疏松提供了新策略。
研究思路
-
提出假设:皮肤老化可能通过某种机制影响骨代谢,导致骨质流失。
-
建立实验模型:为验证假设,使用小鼠模型,通过局部应用D-半乳糖诱导皮肤早衰,观察其对骨质的影响。这一模型能够模拟自然衰老过程中的皮肤和骨骼变化。
-
关键因子的识别:研究团队重点关注Cystatin-A(Csta),一种由角质形成细胞分泌的因子,探讨其在皮肤老化与骨质疏松之间的作用。通过分析小鼠和人类样本,研究者发现Csta的表达和分泌随着年龄的增长而减少。
-
机制研究:文章进一步探讨Csta如何通过与Rack1(激活C-激酶1的受体)结合,调节成骨细胞和破骨细胞的增殖与分化。研究者发现Csta促进前成骨细胞的增殖,同时抑制破骨细胞的分化,从而影响骨代谢。
-
干预措施的探索:通过测试了局部应用calcipotriol(维生素D类似物)对Csta产生的影响,发现其能够刺激Csta的分泌,进 而缓解骨质疏松。这一发现为老年性骨质疏松症的治疗提供了新的思路。
-
结果的验证与应用:通过一系列实验(如免疫组化、流式细胞术、ELISA、抗体芯片技术【RayBio QAH-CAA-640】等),验证了Csta在骨代谢中的关键作用,并提出了通过调节Csta水平来治疗骨质疏松的潜在策略。
-
最后,文章总结了皮肤老化与骨质疏松之间的关系,强调了Csta作为一种内分泌因子在这一过程中的重要性,并指出未来研究的方向,包括进一步探索Csta的作用机制和临床应用。
- 研究结果
-
皮肤早衰诱导小鼠骨质流失
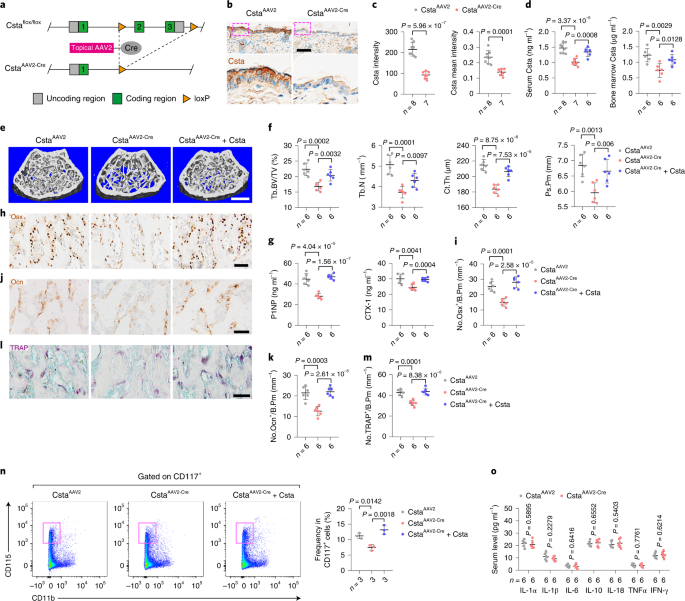
研究团队发现老年小鼠表皮厚度与骨量正相关,支持皮肤老化与骨质流失的关联。研究团队提出假设:皮肤衰老导致了骨骼衰老。首先,通过在年轻小鼠皮肤上应用D-半乳糖诱导早衰(衰老角质形成细胞集聚,图1c、d),观察到骨质流失,包括小梁骨和皮质骨的减少。D-半乳糖处理导致分别代表骨形成和骨吸收活性的,P1NP和CTX-I水平降低,表明骨形成和吸收均受影响。骨形成参数下降40-50%,超过骨吸收参数约20%的下降,特征与老年骨质疏松症相符。研究排除了炎症的介导作用,证实皮肤衰老导致低骨转换,损害骨形成和吸收。
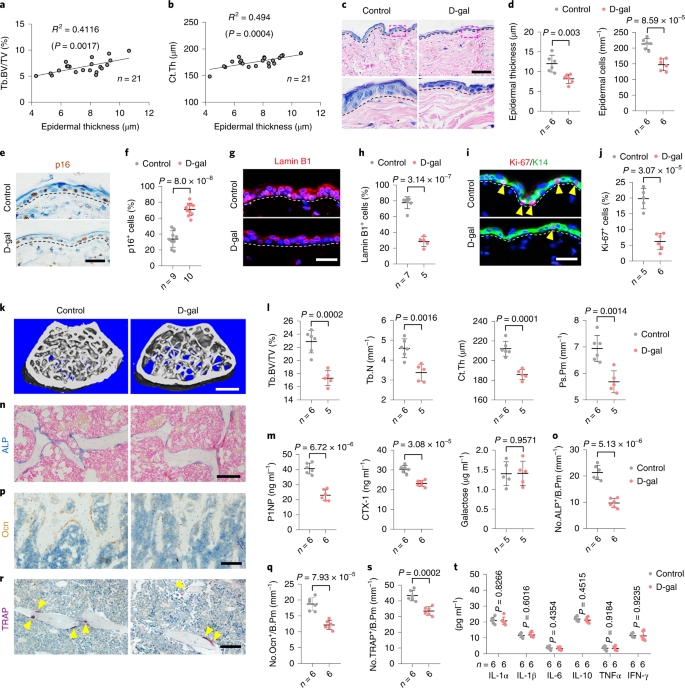
Cystatin-A是参与年龄相关骨丢失的
皮肤分泌蛋白
研究发现皮肤衰老可能通过分泌因子影响骨质流失。通过使用包含640种特异性抗体的细胞因子抗体芯片【RayBio QAH-CAA-640】分析,研究者比较了年轻和老年男性患者血清中的细胞因子,发现41种细胞因子表达差异显著,其中Csta(Cystatin-A)是主要由角质形成细胞表达和分泌的11 kDa蛋白。免疫染色显示Csta在表皮角质形成细胞中特异性表达,其表达水平随细胞分化程度增加而增加。进一步分析发现,皮肤中Csta的表达量是肺的10倍,骨的45倍,表明皮肤是Csta的主要来源。
随着年龄增长,皮肤中Csta的蛋白和mRNA水平,以及血清和骨髓中的分泌水平降低,与表皮变薄和骨丢失相关。在21只老年小鼠中,血清Csta水平与骨量呈正相关。
研究团队采用卵巢切除(OVX)小鼠模型模拟绝经后雌激素的丧失,也显示出类似的Csta表达下降。这些结果揭示了Csta作为一种皮肤分泌蛋白,在年龄相关的骨丢失中扮演重要角色。
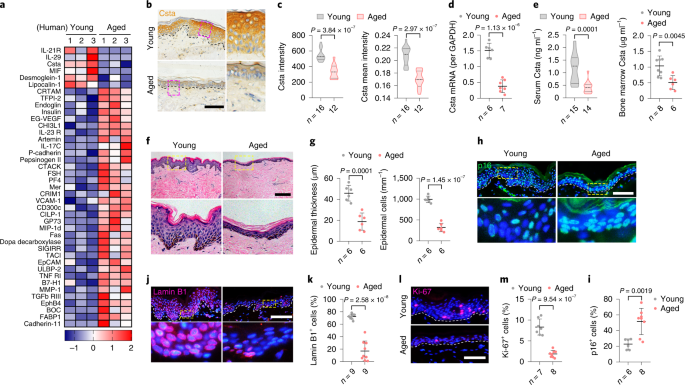
表皮中Csta的减少导致小鼠年龄相关性
骨丢失
为了确定皮肤Csta在骨中的作用,研究团队构建了Csta条件敲除小鼠,Cre研究表明优化的AAV2-Cre载体在局部给药后有效,且特异性地转导表皮角质形成细胞增殖受损,表皮中的Csta消融,导致表皮厚度和角质形成细胞数量减少,同时,血液和骨髓中的Csta浓度均降低,从而进一步表明表皮是体内Csta的主要来源。更重要的是,CstaAAV2-Cre小鼠表现出骨小梁和皮质骨量的显著减少。进一步的分析表明,CstaAV2-Cre小鼠的骨形成参数(血清P1NP水平和成骨细胞谱系细胞数量)(图3g-k)远低于对照组小鼠。尤其是骨小梁和皮质骨量的显著降低。CstaAAV2-Cre小鼠的骨形成和吸收参数均降低,表现出低骨转换状态。补充Csta能够逆转低骨量减少表型,表明表皮Csta的减少与老年性骨质疏松症有关。进一步,通过局部应用AAV2-Csta在老年小鼠中过表达Csta,发现能增加骨量和骨转换,证实了Csta在年龄相关性骨丢失中的作用。
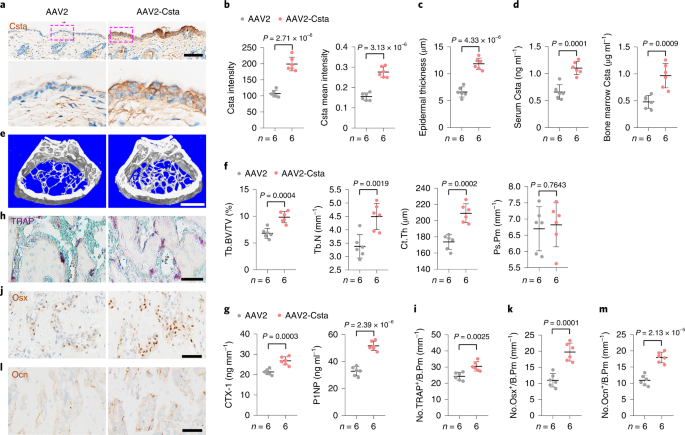
局部应用calcipotriol通过刺激表皮
Csta产生缓解老年性骨质疏松症
通过上述研究结果,研究团队推断增加表皮Csta分泌可能是缓解老年骨质疏松症的一种策略。研究发现,随着皮肤老化,人类和小鼠中Csta表达的主要部位——基底上分化的角质形成细胞比例减少。钙泊三醇(MC903,Dovonex)作为1,25-二羟基维生素D3的类似物,能够刺激角质形成细胞分化和Csta表达。在老年小鼠皮肤上局部应用低剂量钙泊三醇,未引起高钙血症或健康问题,但显著增加了表皮厚度和Csta的表达及分泌。此外,钙泊三醇处理的小鼠显示出骨吸收和骨形成增加,且不影响血清中1,25[OH]2D3、25-羟基维生素D3和甲状旁腺激素水平,表明其低全身吸收和低钙活性。Csta的破坏抵消了钙泊三醇对骨的有益作用,证实了其在骨丢失中的作用。
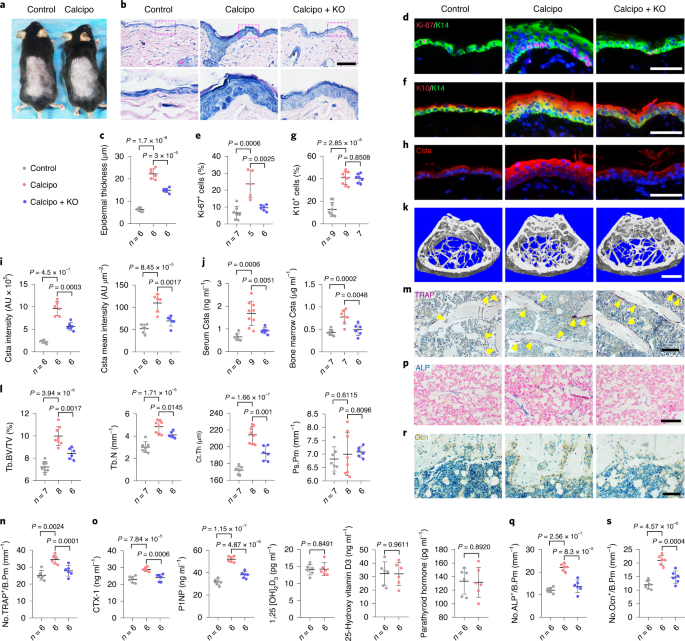
Csta不同程度地协调成骨细胞和破骨细
胞的增殖和分化
研究团队研究了Csta如何差异性调节成骨细胞和破骨细胞的形成。CstaAAV2-Cre小鼠模型显示,Csta能促进骨中前成骨细胞和破骨细胞前体的增殖。体外实验中,Csta通过增加S期前成骨细胞数量和调节G1/S转换来促进细胞周期进程,增加细胞周期蛋白D1表达,抑制p27,诱导Rb磷酸化。Csta同样促进破骨细胞前体的增殖,但抑制其分化,减少肌动蛋白环形成和骨吸收活性。Csta不影响前成骨细胞向成骨细胞的分化,也不影响其碱性磷酸酶活性或矿化能力。Csta处理的MSCs增加CFU-Fs数量,但不影响CFU-OB形成,表明Csta促进MSCs自我更新,不影响其成骨承诺。Csta抑制破骨细胞分化,消除RANKL诱导的NF-κB和MAPK活化,阻止破骨细胞前体分化为破骨细胞。Csta的差异调节作用解释了其在老年骨质疏松症中的作用,特征是骨形成减少超过骨吸收减少。

Csta与Src竞争绑定Rack1
研究团队探讨了Csta如何协调骨细胞的增殖和分化。由于破骨细胞前体对Csta更敏感,研究者使用BMM细胞与GST标记的Csta孵育,发现Csta在5分钟内增加并累积至少2小时,表明Csta被细胞内化。通过共免疫沉淀和蛋白质组学分析,发现Rack1是Csta的潜在结合伙伴,Rack1在调节细胞活性中起枢纽作用。Csta可能通过竞争Rack1结合来影响细胞增殖和分化。使用ZDOCK蛋白对接算法,研究者模拟了Csta-Rack1复合物的3D结构,发现Csta的Arg 10与Rack1的Pro 243可能发生结合,使Csta能与Src竞争Rack1。实验中,Csta处理破坏了Rack1-Src复合物,增加了Src激酶活性,而Rack1过表达则逆转了这些效应。这些结果表明Csta通过与Rack1的相互作用来协调骨细胞的增殖、分化和功能。
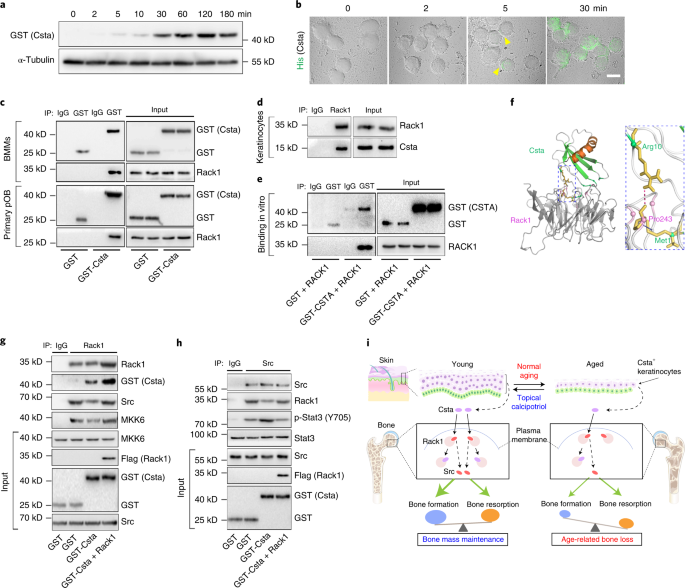
总结 本研究揭示了皮肤老化与骨质疏松症之间的因果关系,并确定了Csta作为连接皮肤老化和骨质流失的关键分子。Csta通过与Rack1相互作用,调节骨细胞的增殖和分化。此外,研究还发现局部应用calcipotriol能够通过刺激Csta的产生来缓解骨质疏松症,为临床治疗提供了新的策略。这些发现不仅增进了我们对皮肤老化和骨质流失之间联系的理解,也为开发针对老年骨质疏松症的新疗法提供了科学依据。 文献:Liang W, Chen Q, Cheng S, Wei R, Li Y, Yao C, Ouyang Z, Kang D, Chen A, Liu Z, Li K. Skin chronological aging drives age-related bone loss via secretion of cystatin-A. Nature Aging. 2022 Oct;2(10):906-22. https://www.nature.com/articles/s43587-022-00285-x