瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
Cell Death and Disease(IF:8.469)| 抗体芯片助力“CAF和肝癌细胞相互作用机制研究”中的新发现
661 人阅读发布时间:2022-07-13 16:42
杂志名称:Cell Death and Disease
影响因子:8.469
文献题目:Cancer associated fibroblast–derived CCL5 promotes hepatocellular carcinoma metastasis through activating HIF1α/ZEB1 axis
第一作者:Haixu Xu,Jie Zhao
通讯作者:Zhi Yao and Qiong Xu
作者单位:Department of Immunology, Key Laboratory of Immune Microenvironment and Disease of the Educational Ministry of China, Tianjin Key Laboratory of Cellular and Molecular Immunology, School of Basic Medical Sciences, Tianjin Medical University, 300070 Tianjin, China.
本实验所用产品:Human Cytokine Array G1000 (AAH-CYT-G1000, RayBiotech, Atlanta, USA)
实验样品:细胞上清
研究摘要:
癌相关成纤维细胞(CAF)是肝癌细胞(HCC)微环境中最丰富的成分之一,与HCC的转移和侵袭密切相关。研究团队鉴定了CAF衍生的趋化因子CCL5通过触发HIF1α/ZEB1轴增强HCC转移的机制。研究证明来源于HCC组织的CAFs促进了HCC细胞的迁移和侵袭,并促进了NOD/SCID小鼠的肺转移。然后,趋化因子抗体芯片阐明了CAFs分泌的趋化因子CCL5水平高于癌旁组织成纤维细胞(PTF)。在机制上,研究团队发现CAF衍生的CCL5通过结合特定受体抑制缺氧诱导因子1α(HIF1α)的泛素化和降解,在常氧条件下维持HIF1α,从而上调下游基因锌指增强子结合蛋白1(ZEB1)并诱导上皮间充质转化(EMT),最终验证其促进肝癌肺转移的能力。这种新机制可能与预后不良有关。总之,靶向CAF衍生的CCL5介导的HIF1α/ZEB1级联可能为HCC提供了一种新的治疗途径。
结果:
1.1 肝癌组织中CAFs的鉴定和分化潜能
为了阐明CAFs在HCC进展中的作用,研究团队通过使用免疫组织化学染色检测了HCC组织和癌旁组织中α-SMA的表达。结果显示,HCC组织中积聚的活化成纤维细胞比相应癌旁组织中的成纤维细胞多;从肝癌组织和癌旁组织中分离和培养CAF和PTF,具有向脂肪细胞和成骨细胞分化的潜力;并发现CD105、CD73、CD90、CD44为阳性,CD31、CD45、CD34和HLA-DR为阴性,表明CAF具有间充质细胞的特征(图1)

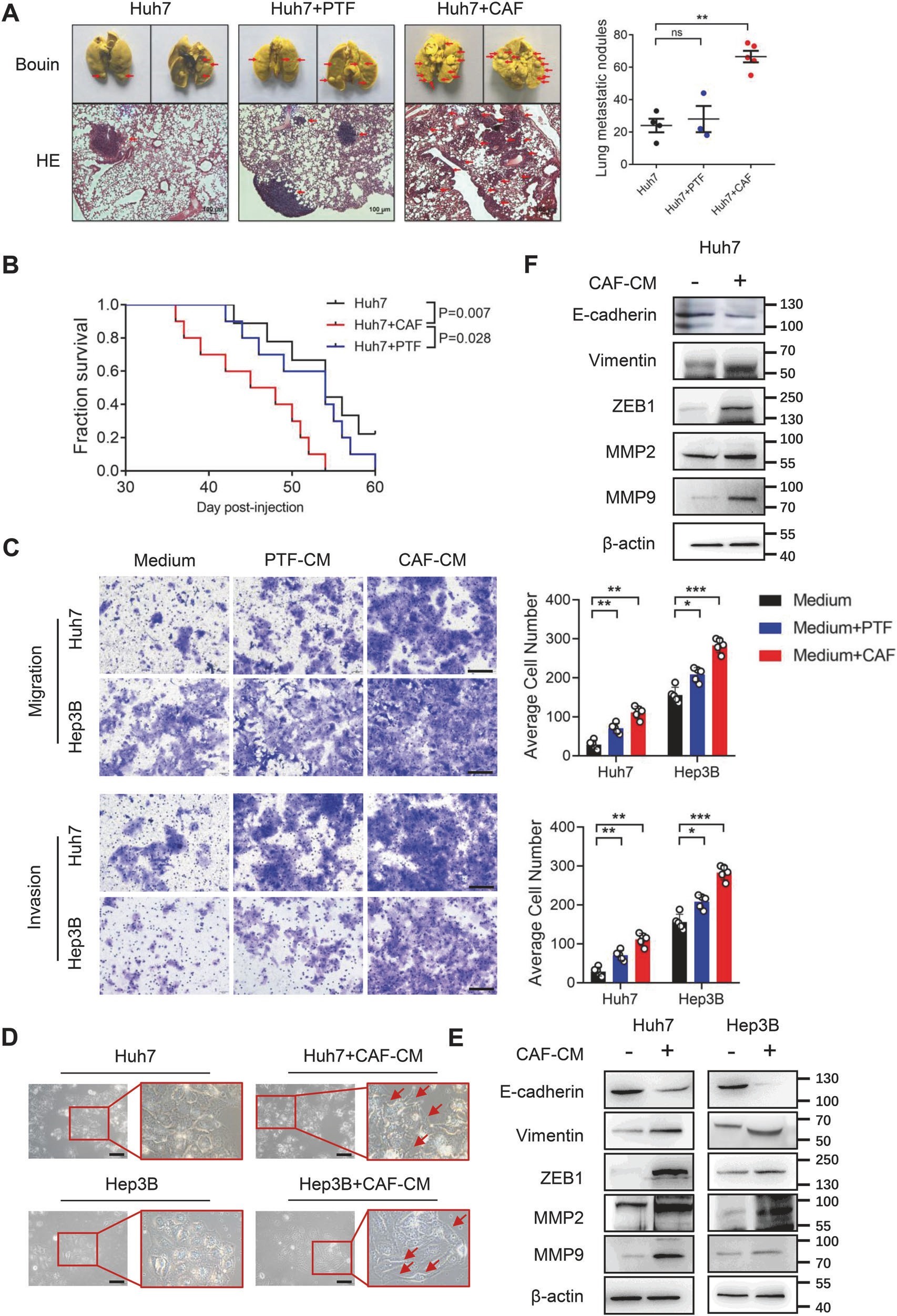
1.2 CAFs促进肝癌细胞的转移
研究团队为了进一步阐明CAFs对HCC进展的影响,将Huh7细胞单独或与CAFs或PTFs建立了动物模型,通过观察发现CAFs促进了肝癌向双肺的扩散,从而影响了肿瘤的进展和预后,在Transwell分析结果中得出Huh7和Hep3B细胞都表现出更强的转移能力,并且CAF对HCC细胞转移能力的影响比PTF更为显著,以及CAFs通过分泌多种生长因子或趋化因子诱导EMT增强肿瘤细胞侵袭转移能力,在WB结果中展示了CAFs诱导EMT促进HCC细胞转移(图2)。
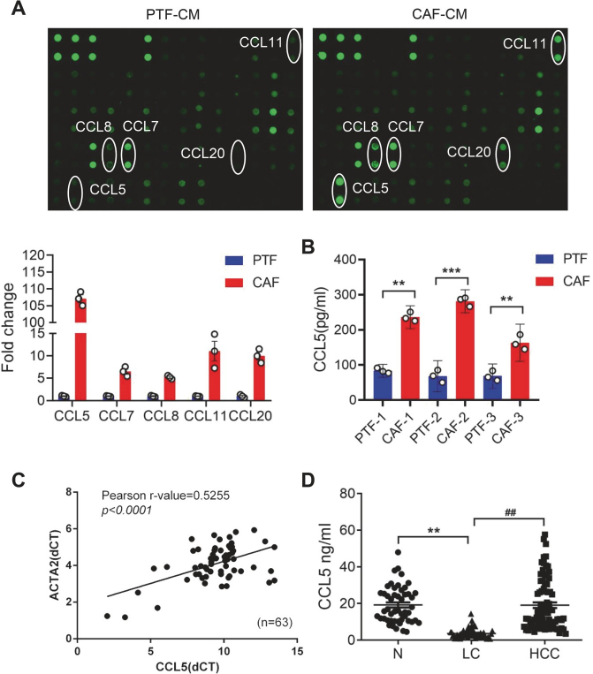
1.3抗体芯片检测CAFs和PTFs分泌蛋白谱差异
研究团队为了发现CAFs CM中促进转移的重要分泌因子,通过使用Human Cytokine Array G1000 (AAH-CYT-G1000, RayBiotech, Atlanta, USA)检测CAF-CM和PTF-CM的趋化因子表达;结果显示CCL5、CCL7、CCL8、CCL11和CCL20(以圆圈突出显示)在CAF-CM中的表达显著高于PTF-CM,特别是CCL5的表达最为显著(图3A)另外,通过Pearson相关分析显示CCL5与ACTA2在63例肝癌中的表达呈正相关,以及在ELISA的双重验证下进一步证明了CAFs中CCL5蛋白水平的增加这一结果(图3),因此,研究团队推测CCL5可能是CAF促进HCC转移的重要调控因子之一。
1.4 CCL5促进HCC转移并上调HIF1α
为了进一步阐明来源于CAFs的CCL5是否是HCC细胞转移的潜在启动子。研究团队使用不同浓度的CCL5发现增加了Huh7和Hep3B细胞的迁移和侵袭能力,而CCL5中和抗体持续显著抑制CAFs诱导Huh7和Hep3B细胞的迁移、侵袭或EMT(图4)。
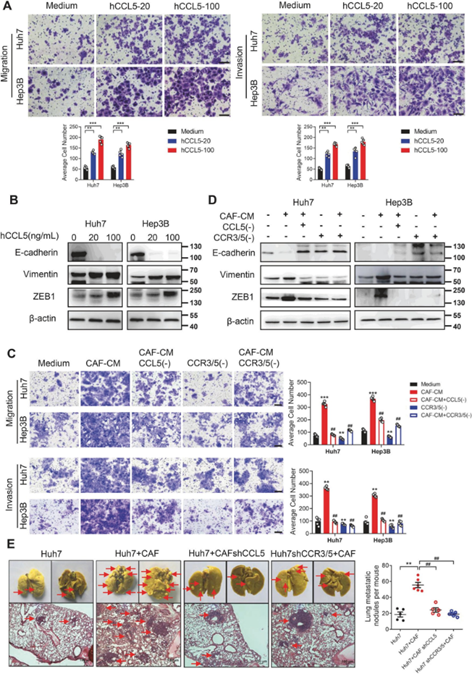
研究团队证实了hCCL5对Huh7和Hep3B细胞HIF1α mRNA和蛋白表达的上调,也证实了CAF-CM对HIF1α的促进作用,而CCL5中和抗体和CCR3/5拮抗剂则消除该作用,结果提示CAFs通过分泌CCL5上调肝癌组织HIF1α的表达。
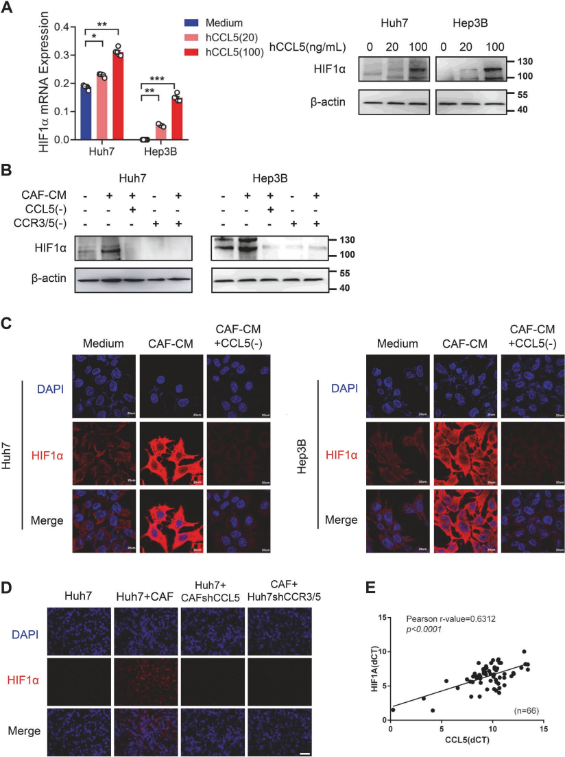
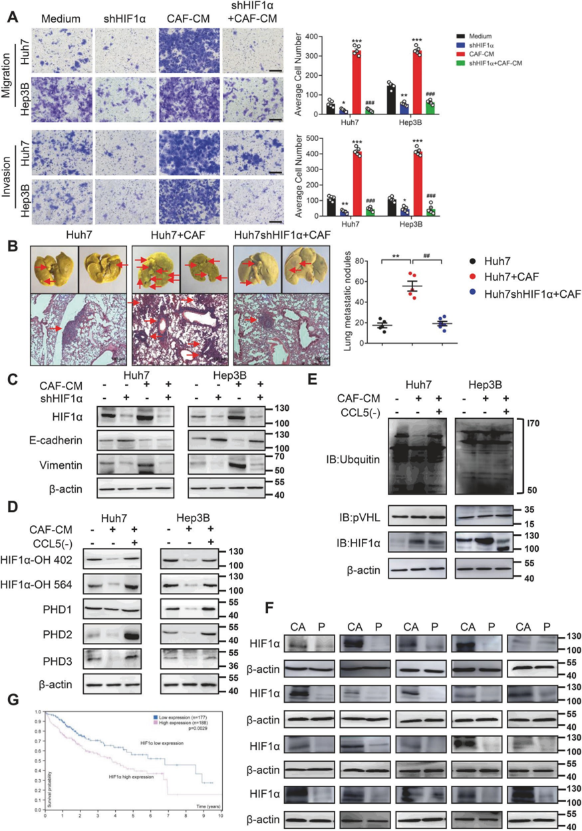
1.5 ZEB1与HIF1α调节CCL5诱导的肝癌细胞EMT和转移
为了阐明HIF1α是否是CCL5促进HCC转移的下游因子,研究团队将Huh7和Hep3B细胞中的HIF1α敲除;观察到CAFs介导的转移显著受到抑制。通过WB实验发现CAF-CM能显著抑制肝癌细胞中HIF1α-OH 402、HIF1α-OH 564和PHDs的表达,同时抑制HIF1α泛素和pVHL的水平,CCL5中和抗体可解除上述抑制作用(图6)。
研究团队结合芯片分析了HIF1α在ZEB1启动子区的6个结合位点的富集情况,结果发现HIF1α通过直接与ZEB1结合来调节其转录和表达,而敲除肝癌细胞中的ZEB1可以有效地抑制CAF诱导的EMT和转移,提示ZEB1是HIF1α调节CAF诱导的CCL5诱导的肝癌细胞EMT和转移的下游关键因子(图7)。

结论:
研究团队通过使用Human Cytokine Array G1000 (AAH-CYT-G1000, RayBiotech, Atlanta, USA)检测CAF-CM和PTF-CM的趋化因子表达,帮助找到参与CAF和肝癌细胞相互作用的关键调节因子—“CCL5”,随后证实了CCL5在调控CAFs与HCC转移关系中的重要作用,通过激活HIF1α/ZEB1信号轴促进HCC转移。另一方面,通过抗体芯片的使用帮助研究团队在CAFs在肿瘤微环境中促进HCC细胞的侵袭和转移机制研究中起到关键作用,以及帮助揭示肝癌潜在的治疗靶点并为临床治疗肝癌提供新的思路。