瑞博奥(广州)生物科技股份有限公司
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
Raybiotech抗体芯片在精神压力调控肿瘤免疫应答中的应用
566 人阅读发布时间:2020-07-10 13:59
杂志名称:Nature medicine
文献题目:Stress–glucocorticoid–TSC22D3 axis compromises therapy-induced antitumor immunity
第一作者:Heng Yang
通讯作者:Yuting Ma
作者单位: 中国医学科学院和北京协和医科大学
本实验所用产品:AAM-BLG-1-4
实验样品:小鼠血浆
研究背景:
长期以来,人们普遍认为精神压力与恶性疾病的发病率以及治疗相关联,虽然在流行病学中也显示焦虑、抑郁等精神障碍在肿瘤患者中普遍存在(特别是在结直肠,前列腺,胰腺癌等癌症中),但是精神压力是否影响癌症的发生、进展及治疗,目前尚未得到详细研究。此外,手术、放化疗等也可能诱发或加重焦虑、抑郁等精神障碍,这都会对治疗效率有影响,因此该研究团队迫切寻找精神压力与肿瘤进展与治疗中的关系。
众所周知,免疫系统是以系统而非局部的方式组织起来的(“免疫系统”),它深受神经内分泌因子的影响,例如在精神压力下糖皮质激素明显增加,而免疫系统在肿瘤治疗过程中发挥着至关重要的作用,其中免疫应答异常与肿瘤的发生、发展密切相关,那么精神压力是否影响免疫应答从而导致肿瘤的发生。针对这个问题,研究组解析了精神压力导致的神经内分泌系统与免疫系统之间的机制以及其对免疫治疗、化疗后的影响。
1 结果
1.1 社交挫败影响肿瘤治疗和免疫监视
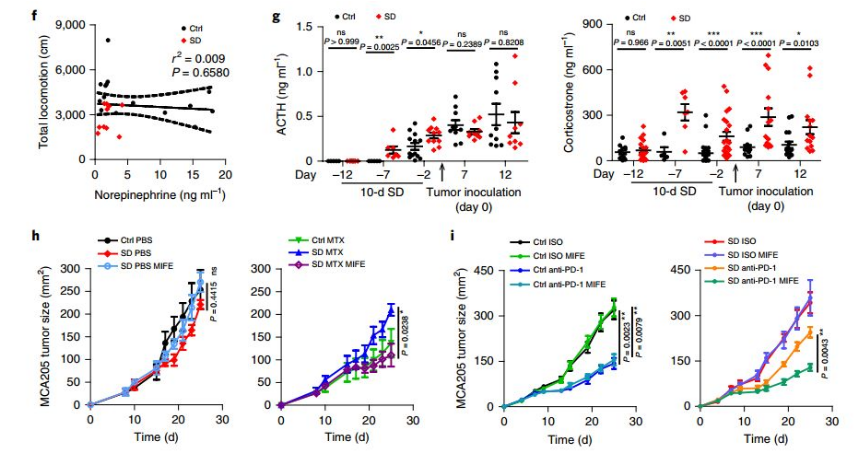
为了验证精神压力是否对肿瘤治疗有影响,研究者建立了小鼠重复社交挫折模型SD和急性束缚模型AR,并通过旷场、明暗盒、仪容整理、社交躲避等多种行为学测试指标来量化小鼠的焦虑及抑郁表型。研究者发现在肺癌,直肠癌模型小鼠中,精神压力可导致肿瘤局部及全身系统性的免疫抑制,从而阻碍化疗、肿瘤疫苗、PD-1单抗治疗的效果。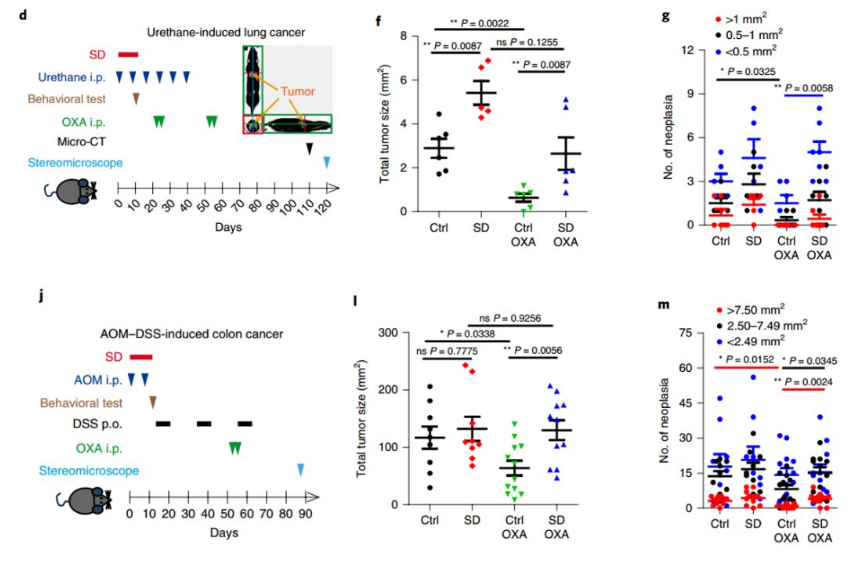
1.2 社交失败导致免疫微环境的改变
为了研究社交压力对免疫抑制的潜在影响,研究者用流式荧光分析结果揭示出在SD处理组中,小鼠T淋巴细胞和中性粒细胞减少,而巨噬细胞的密度明显增加,并且不能干扰肿瘤浸润树突状细胞的数量。接着研究者用Raybiotech(AAM-BLG-1-4)抗体芯片,筛选出IFN-beta,IL-15,CXCL1,CXCL9等生长趋化因子在SD小鼠中明显缺陷,进一步证明了社交压力会对治疗诱导的抗癌免疫反应产生负面的影响。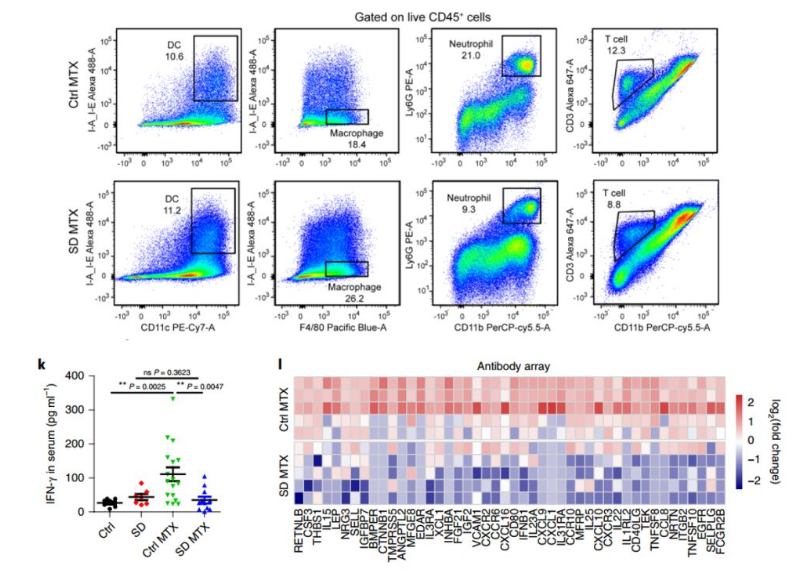
1.3 紧张引起的糖皮质激素升高抑制肿瘤免疫应答
为了建立SD与免疫抑制机制间的关系,研究者探索了一系列神经内分泌应激介质,其中皮质酮上调可使DC细胞内Tsc22d3表达增强,而该分子可抑制肿瘤内DC细胞的I型干扰素应答,并下调其MHC-I/II抗原提呈途径相关分子的表达。在正常小鼠中,人为给予外源性糖皮质激素、或使小鼠的DC细胞特异性过表达Tsc22d3,化疗及免疫治疗的应答效率显著下降。反之,条件性敲除小鼠DC细胞的Tsc22d3基因,即使施加SD预处理或人为给予外源性糖皮质激素,小鼠仍然可保持对化疗及免疫治疗的敏感性。因此得到SD诱导的糖皮质激素张力升高可以独立于血清素能和肾上腺素能系统发生,并诱导免疫抑制使化疗和免疫治疗无效。
1.4 糖皮质激素诱导的Tsc22d3调控免疫抑制
为了探讨Tsc22d3在肿瘤免疫应答中起到的作用,研究者借助对肿瘤公用数据库的深入挖掘,比较了肿瘤患者与正常人cortisol水平的差异,并且发现了肺癌(有吸烟经历者)、肠癌、胃癌组织中高水平的TSC22D3表达与不良预后具有相关性,而受TSC22D3抑制的I型干扰素应答代表基因CXCL9及CCL5的低表达也与不良预后显著相关。因此TSC22D3在应激或糖皮质激素诱导的癌症治疗相关免疫抑制中发挥重要作用。当TSC22D3在树突状细胞中高度表达时,它可以抑制癌症治疗诱导的免疫应答,而从树突状细胞中去除TSC22D3,可以消除糖皮质激素介导的免疫抑制,这些发现促使患者的精神压力管理和合成糖皮质激素在免疫依赖性癌症治疗中的应用需谨慎。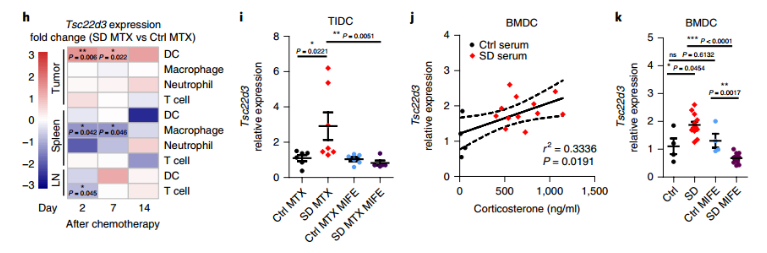
结论:该研究证明精神压力等应激反应能够诱导糖皮质激素的迅速上升和Tsc22d3上调,抗体芯片检测结果显示所有重要免疫指标均被抑制,这会削弱抗癌疗法诱导的免疫监视作用,诱导免疫抑制降低化疗,免疫治疗等疗法的效率。此外在多种癌症包括消化道癌症、肺癌及黑色素瘤患者中也发现血浆皮质醇水平及TSC22D3在循环白细胞中的高表达,这与患者的消极情绪密切相关,并且预示较差的预后及生存率。因此糖皮质激素及其下游效应分子Tsc22d3可能作为“免疫检查点”,中和或阻断其作用可能有效地提高抗癌治疗的疗效。另一方面也提示人们需要多关注患者的精神障碍及调节、谨慎使用糖皮质激素类药物,为提高疗效提供了新的战略思路。
引用文献:
1. Dagogo-Jack, I. & Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nat. Rev. Clin. Oncol. 15, 81–94 (2018).
2. Galluzzi, L., Buque, A., Kepp, O., Zitvogel, L. & Kroemer, G. Immunological efects of conventional chemotherapy and targeted anticancer agents. Cancer Cell 28, 690–714 (2015).
3. Cain, D. W. & Cidlowski, J. A. Immune regulation by glucocorticoids. Nat. Rev. Immunol. 17, 233–247 (2017)
4. Tormann, V. et al. Genomic dissection of enhancers uncovers principles of combinatorial regulation and cell type-specifc wiring of enhancer-promoter contacts. Nucleic Acids Res. 46, 2868–2882 (2018).
5. Zilionis, R. et al. Single-cell transcriptomics of human and mouse lung cancers reveals conserved myeloid populations across individuals and species. Immunity 50, 1317–1334 e1310 (2019).